ОБОСНОВАНИЕ ЦЕЛИ
Разметка медицинских изображений, особенно в задачах сегментации, требует значительных временных и человеческих ресурсов. При этом ограниченный объём размеченных данных снижает обобщающую способность моделей, что может привести к ошибкам в диагностике. Использование автоматической генерации масок на основе предобученной модели позволяет быстро и эффективно расширить датасет без привлечения специалистов.
Целью данной работы является создание и внедрение скрипта для автоматической генерации сегментированных масок поражённых участков лёгких на рентгеновских снимках. Это решение призвано повысить качество и стабильность последующего обучения модели, а также сократить затраты времени на подготовку данных.
ОПИСАНИЕ ПОДХОДА
Для генерации масок поражённых участков лёгких на рентгеновских снимках был применён комплексный подход, основанный на использовании заранее размеченных данных и обученной нейросетевой модели сегментации. Основной целью данного этапа является формирование дополнительных разметок, которые в дальнейшем будут использоваться для анализа, обучения других моделей или валидации существующих решений.
В работе использовались несколько открытых медицинских датасетов, включающих снимки грудной клетки, на которых уже присутствуют маски с отмеченными зонами поражения. Для обучения и валидации модели был использован объединённый датасет, включающий свыше 27 000 изображений, размеченных соответствующими масками. Использование крупного объёма данных обеспечило высокую обобщающую способность модели. В ходе экспериментальной оценки были достигнуты следующие метрики качества: AUC > 97%, IoU > 80% (в среднем по классам), что свидетельствует о высокой точности сегментации и способности модели к достоверному выделению патологических структур на изображениях.
В основу решения легла мультитаск-архитектура на базе энкодера EfficientNetB4, реализующая одновременную классификацию заболевания и сегментацию поражённых областей. Такой подход позволяет учитывать, как глобальную информацию об изображении, так и локальные признаки, что особенно актуально в задачах медицинской визуализации.
Всего было собрано порядка 27 000 изображений, сгруппированных по следующим клиническим категориям:
- COVID-19
- Рак лёгких
- Вирусная пневмония
- Помутнение лёгких
- Здоровые лёгкие
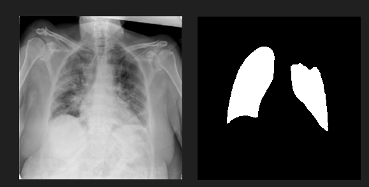
Рисунок 1. Изображение из датасета с больными легкими и прикреплённая маска
Обучение проводилось на объединённом наборе изображений с применением техник аугментации и валидации на отложенной выборке. Результаты показали высокое качество работы модели, что подтверждается следующими метриками:
Таблица 1.
Метрики обученной модели
|
Метрики |
Значение |
|
Accuracy (Классификация) |
96.7% |
|
AUC (Площадь под ROC-кривой) |
0.981 |
|
Mean IoU (Пересечение/Объединение масок) |
0.941 |
Высокие значения метрик позволяют с уверенностью использовать модель для генерации масок на новых данных. Полученные сегментированные изображения визуально подтверждают точность и полноту выделения поражённых участков. На рисунке ниже представлены примеры работы модели: исходное изображение, карта поражения и итоговое наложение маски на изображение.
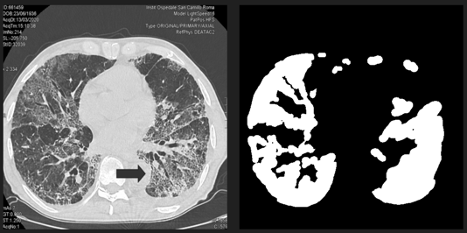
Рисунок 2. Рак легких и сгенерированная маска
Таким образом, модель успешно применяется в качестве инструмента для автоматического дополнения датасета размеченными примерами. Это значительно упрощает подготовку обучающей выборки и способствует созданию более устойчивых и точных диагностических решений на основе искусственного интеллекта.
ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ
Разработанное решение может быть интегрировано в различные практические области, в том числе:
- в системы поддержки принятия врачебных решений (Clinical Decision Support Systems, CDSS);
- при подготовке обучающих материалов для специалистов в области лучевой диагностики;
- в качестве инструмента предобработки и генерации аннотированных данных для последующего машинного обучения.
Интеграция предложенной системы в существующие решения хранения и анализа медицинской информации (например, PACS-системы) может существенно повысить эффективность диагностических процессов, особенно в условиях высокой нагрузки на медицинский персонал или дефицита квалифицированных кадров.
ВЫВОДЫ
Результаты проведённой работы имеют как теоретическое, так и практическое значение. Предложенный подход демонстрирует возможность повышения точности и надёжности автоматизированного анализа рентгеновских изображений, а также сокращения времени, затрачиваемого на подготовку обучающих данных, что делает его актуальным и востребованным в сфере медицинских информационных систем.
Визуальные примеры работы модели демонстрируют корректную локализацию патологических изменений. Разработанный программный инструмент позволил существенно расширить исходную обучающую выборку путём генерации дополнительных масок, что имеет важное значение в контексте ограниченности доступных размеченных медицинских данных.
Список литературы
- Тан, М., Ле, К. EfficientNet: масштабирование сверточных нейронных сетей [Текст] / М. Тан, К. Ле. // Proceedings of the 36th International Conference on Machine Learning, 2019. – №97. – C. 6105-6114
- Сетио, А.А.А. Обнаружение узелков в легких на КТ-снимках: снижение ложноположительных результатов с использованием сверточных нейросетей [Текст] / А.А.А. Сетио и др. // IEEE Transactions on Medical Imaging, 2016. – Т. 35. – №5. – С. 1160-1169
- Роннебергер, О. Сверточные сети для сегментации биомедицинских изображений (U-Net) [Текст] / О. Роннебергер, П. Фишер, Т. Брокс. // Medical Image Computing and Computer-Assisted Intervention – MICCAI, 2015. – №9351. – С. 234-241
- Чоудхури, М. База данных рентгеновских снимков COVID-19 [Текст] / М. Чоудхури, Т. Шубхам, Д. Бхатачария. // Kaggle Dataset, 2020. – URL: https://www.kaggle.com/tawsifurrahman/covid19-radiography-database



