Введение
Инфекционные заболевания продолжают оставаться значимой угрозой общественному здоровью, являясь одной из основных причин заболеваемости и смертности во всем мире. Примером является пандемия COVID-19, которая унесла миллионы жизней, подчёркивая необходимость раннего выявления и предотвращения распространения заболеваний. Современные вызовы включают трудности с быстрой диагностикой, растущую антимикробную резистентность и необходимость междисциплинарного подхода для их решения [1][2][3]. Глобализация и увеличение мобильности населения способствуют более быстрому распространению инфекций, что требует усиленного мониторинга и международного сотрудничества. Изменение климата также оказывает влияние на распространение инфекционных агентов, расширяя ареалы обитания переносчиков таких заболеваний, как малярия и лихорадка денге.
Использование технологий больших данных и искусственного интеллекта (ИИ) стало ключевым направлением в эпидемиологии и медицине. Эти подходы позволяют анализировать большие объёмы данных, выявлять скрытые закономерности и прогнозировать вспышки заболеваний, предоставляя значительную помощь в диагностике и поддержке принятия клинических решений. Прогнозирование вспышек инфекционных заболеваний, ранняя диагностика и разработка персонализированных решений стали возможны благодаря интеграции ИИ в медицинские исследования [1][3]. Технологии машинного обучения и глубокого обучения используются для обработки геномных данных, что позволяет лучше понимать механизмы патогенеза и устойчивости микроорганизмов. Также важным направлением является использование ИИ для оптимизации логистики в здравоохранении, что включает управление ресурсами, планирование медицинских кампаний и распределение вакцин.
1 Направления использования ИИ в эпидемиологии
1.1 Основные направления использования ИИ
Применение искусственного интеллекта (ИИ) в эпидемиологии охватывает несколько ключевых направлений, которые существенно улучшают процесс контроля и предотвращения инфекционных заболеваний. Благодаря мощным вычислительным возможностям и способности обрабатывать большие объёмы данных, ИИ позволяет выявлять тенденции и закономерности, которые ранее были скрытыми или трудно обнаружимыми с использованием традиционных методов. Интеграция ИИ в эпидемиологические исследования способствует более точному моделированию распространения инфекций, оптимизации стратегий вмешательства и улучшению общего понимания динамики заболеваний. Кроме того, ИИ поддерживает разработку инновационных решений для мониторинга здоровья населения и оценки эффективности проводимых мер (рис. 1). Основные направления включают:
Прогнозирование вспышек заболеваний.
Алгоритмы машинного обучения помогают анализировать данные, такие как климатические условия, плотность населения и другие эпидемиологические факторы, для оценки вероятности вспышек. Примеры успешного применения включают разработку систем, способных оценивать риск инфицирования на основе видеозаписей и других источников данных [2].
Диагностика заболеваний.
ИИ позволяет ускорить и повысить точность диагностики инфекций с использованием данных клинических испытаний, изображений и других биологических данных. Это особенно важно в условиях роста числа заболеваний с антимикробной резистентностью [1][3].
Поддержка клинических решений.
Системы поддержки принятия решений на основе ИИ предлагают врачам рекомендации по лечению, подбору антимикробных препаратов и мониторингу состояния пациентов, способствуя персонализированному подходу в лечении [1].
Рисунок 1. Схема направлений использования ИИ в эпидемиологии
1.2 Дополнительные направления применения ИИ
Кроме основных направлений, ИИ находит применение и в других аспектах эпидемиологии. В разработке вакцин и лекарств ИИ помогает моделировать молекулярные взаимодействия между патогенами и потенциальными лекарственными средствами, что ускоряет процесс поиска эффективных препаратов. Также алгоритмы машинного обучения могут анализировать данные клинических испытаний для выявления наиболее перспективных кандидатов и оптимизации дизайна испытаний.
Обработка и анализ больших данных является ещё одним важным направлением. ИИ позволяет объединять данные из электронных медицинских записей, геномных исследований, данных о мобильности населения и социальных медиа для комплексного анализа эпидемиологических тенденций. Методы глубокого обучения используются для обнаружения скрытых закономерностей и предсказания непредвиденных вспышек заболеваний.
Раннее предупреждение и мониторинг также значительно выигрывают от применения ИИ. Обработка естественного языка (NLP) используется для мониторинга упоминаний заболеваний в социальных сетях и новостях, что позволяет выявлять потенциальные вспышки на ранних стадиях. Кроме того, Интернет вещей (IoT) и сенсоры собирают данные в реальном времени о состоянии окружающей среды и здоровья населения, способствуя своевременному реагированию на угрозы.
Образование и информирование населения также получают поддержку от ИИ. Системы ИИ могут предоставлять индивидуализированные советы по профилактике заболеваний на основе анализа личных данных и поведения пользователей. Виртуальные помощники, такие как чат-боты и виртуальные ассистенты, оснащённые ИИ, могут отвечать на вопросы населения о симптомах, мерах предосторожности и доступных медицинских услугах.
1.3 Примеры успешного применения
Применение ИИ в эпидемиологии продемонстрировало свою эффективность на примере пандемии COVID-19. ИИ использовался для прогнозирования распространения вируса, разработки вакцин, анализа медицинских изображений для диагностики и оптимизации распределения медицинских ресурсов. Аналогично, во время вспышек SARS и MERS алгоритмы машинного обучения помогли в моделировании распространения вирусов и разработке стратегий контроля. В эпидемии гриппа ИИ-инструменты анализировали данные о заболеваемости и погодных условиях для предсказания пиковых периодов распространения вируса, что позволило более эффективно управлять ресурсами здравоохранения и принимать превентивные меры.
1.4 Вызовы и ограничения
Несмотря на значительный потенциал, применение ИИ в эпидемиологии сталкивается с рядом вызовов и ограничений. Качество данных является одной из основных проблем: необходимы высококачественные, актуальные и репрезентативные данные для обучения моделей ИИ. Без надлежащих данных точность прогнозов и рекомендаций существенно снижается. Этические вопросы также играют важную роль, особенно касающиеся защиты конфиденциальности данных и обеспечения прозрачности алгоритмов принятия решений. Недостаток вычислительных ресурсов и квалифицированных специалистов может стать серьёзным препятствием для внедрения ИИ-технологий в некоторых регионах. Кроме того, сложность понимания и объяснения решений, принимаемых моделями глубокого обучения, затрудняет их принятие медицинскими специалистами и населением.
1.5 Будущие направления и перспективы
Перспективы развития применения ИИ в эпидемиологии выглядят многообещающими. Интеграция мультидисциплинарных подходов, сочетающих эпидемиологию, биоинформатику и ИИ, позволит разрабатывать более точные и эффективные модели прогнозирования и контроля заболеваний. Автоматизация процессов сбора и анализа данных ускорит реагирование на эпидемические угрозы, делая системы здравоохранения более адаптивными и устойчивыми. Развитие интерпретируемых моделей ИИ обеспечит прозрачность и объяснимость решений, что повысит доверие среди медицинских специалистов и населения. Улучшение международного сотрудничества и обмена данными будет способствовать более эффективному использованию ИИ в глобальном здравоохранении, позволяя своевременно реагировать на новые вызовы и угрозы.
2 ИИ в диагностике и мониторинге инфекционных заболеваний
2.1 Современные методы диагностики
Современные подходы к диагностике инфекционных заболеваний значительно улучшились благодаря применению технологий искусственного интеллекта.
Так, сверточные нейронные сети (CNN) и рекуррентные нейронные сети (RNN) активно используются для анализа медицинских изображений, что позволяет выявлять заболевания на ранних стадиях. Например, модели SVDNet и YOLO применяются для анализа видеозаписей, сегментации и идентификации пациентов с возможными инфекциями, передающимися воздушно-капельным путем, что обеспечивает эффективный эпидемиологический надзор [2].
YOLO (You Only Look Once) — это одностадийный метод детекции объектов, который преобразует входное изображение в сетку (обычно 7×7), где каждая ячейка предсказывает наличие объекта, его класс и параметры ограничивающей рамки. Модель использует свёрточные слои для извлечения признаков, полносвязные слои для регрессии координат рамок и классификации, а на выходе применяет Non-Maximum Suppression (NMS) для подавления дублирующих предсказаний. YOLO обеспечивает высокую скорость обработки (реального времени) благодаря объединению всех этапов детекции в единую модель (рис. 2).
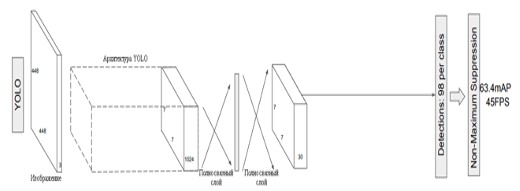
Рисунок 2. Архитектура модели YOLO
SVRNet — это последовательная архитектура, которая включает в себя свёрточные слои с активацией ReLU, слои объединения MaxPooling для снижения размерности и извлечения ключевых признаков, а также полносвязные слои с функцией активации ReLU для формирования итоговых признаков. Финальный слой Softmax используется для классификации, превращая результаты в вероятности по классам. Архитектура проста и линейна, где каждый слой последовательно передаёт информацию следующему (рис. 3).
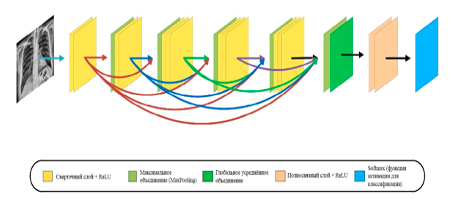
Рисунок 3. Архитектура модели SVDNet
Кроме того, технологии ИИ доказали свою эффективность в анализе медицинских изображений и симптомов. Например, с использованием методов глубокого обучения удалось значительно ускорить диагностику COVID-19 и туберкулёза. Анализ изображений рентгенографии или КТ позволяет не только подтвердить наличие инфекции, но и оценить её тяжесть, что снижает нагрузку на врачей и ускоряет процесс принятия решений [1].
2.2 Проблемы и ограничения
Однако, несмотря на успехи, внедрение ИИ в диагностику сталкивается с рядом проблем.
Во-первых, недостаточная стандартизация данных усложняет автоматическую обработку медицинской информации. Например, интерпретация изображений и двигательных паттернов может быть затруднена из-за различных форматов данных и отсутствия единых протоколов их сбора.
Например, в исследовании Jiang Z. и соавт. [4] описывается удалённая интеллектуальная система скрининга состояния здоровья, которая использует как цветную, так и тепловизионную визуализацию для сбора данных о частоте дыхания человека. Различные типы визуализации требуют единых протоколов обработки и интеграции данных, что усложняет разработку эффективных моделей ИИ и может привести к снижению точности диагностики из-за несоответствия форматов данных и отсутствия унифицированных стандартов их сбора.
Во-вторых, ограниченная доступность данных для редких инфекционных заболеваний усложняет обучение моделей ИИ и снижает их эффективность при переносе на новые условия [1].
Качество данных также остаётся ключевой проблемой. Недостаточно разнообразные обучающие выборки могут приводить к снижению точности моделей, особенно в условиях дефицита информации о редких инфекциях [1].
2.3 Предложения по разрешению проблем
Для преодоления перечисленных ограничений необходимо усилить стандарты сбора данных. Это включает в себя разработку единых протоколов и создание крупных баз данных, доступных для обучения и тестирования моделей ИИ. Например, инициатива MIMIC-III (Medical Information Mart for Intensive Care III) демонстрирует успешный подход к стандартизации и централизованному хранению медицинских данных. MIMIC-III представляет собой обширную базу данных, содержащую анонимизированные медицинские записи более 40 000 пациентов, поступивших в отделения интенсивной терапии Массачусетского технологического института (MIT) и Бостонского медицинского центра.
Благодаря строгим стандартам сбора и обработки данных, MIMIC-III обеспечивает высокое качество и согласованность информации, что позволяет исследователям эффективно использовать её для разработки и тестирования алгоритмов машинного обучения. Доступность этой базы данных для международного научного сообщества способствовала значительному прогрессу в области предсказательной аналитики, диагностики заболеваний и оптимизации клинических решений. Например, многочисленные исследования, основанные на данных MIMIC-III, позволили создать модели ИИ, способные точно прогнозировать исходы лечения, выявлять риски осложнений и поддерживать принятие клинических решений в реальном времени.
Создание таких унифицированных и общедоступных ресурсов данных не только повышает точность и надёжность разработанных моделей, но и способствует воспроизводимости исследований, облегчая верификацию результатов и стимулируя международное сотрудничество. Кроме того, стандартизированные протоколы сбора данных облегчают интеграцию различных источников информации, что позволяет создавать более комплексные и всесторонние модели эпидемиологических процессов.
Также важно внедрять объяснимые модели, которые не только генерируют результаты, но и предоставляют понятное объяснение своих предсказаний, что повысит доверие врачей и минимизирует риск диагностических ошибок [2].
Дополнительно совмещение данных, полученных с помощью ИИ, с традиционными клиническими показателями может значительно улучшить точность диагностики. Например, объединение анализа изображений с биохимическими данными или симптомами позволяет получать более надёжные предсказания и принимать обоснованные решения [1].
3. ИИ в разработке препаратов и вакцин
3.1 Текущие методы разработки препаратов
Современные подходы к разработке лекарственных средств и вакцин значительно выигрывают от использования технологий искусственного интеллекта (ИИ). Так, ИИ активно применяется для поиска новых антибактериальных молекул и оптимизации структуры вакцин. Например, обработка биомолекулярных данных и моделирование взаимодействий патогенов с организмом помогают ускорить идентификацию потенциальных соединений для новых терапий. Методы машинного обучения позволяют эффективно анализировать молекулярные структуры и прогнозировать биологическую активность соединений, что особенно важно при создании вакцин против новых и редких инфекционных заболеваний [3].
Дополнительно ИИ используется для планирования и управления массовыми прививочными кампаниями. Анализ больших данных помогает определять группы риска, разрабатывать стратегии вакцинации и отслеживать эффективность массовой иммунизации. Такие системы позволяют проводить моделирование эпидемических сценариев и улучшать подходы к предотвращению распространения инфекций [2].
3.2 Проблемы и ограничения
Несмотря на успехи, существуют значительные ограничения в применении ИИ для разработки препаратов и вакцин.
Во-первых, генерализуемость моделей остаётся серьёзной проблемой. Многие алгоритмы, обученные на известных патогенах, показывают низкую эффективность при работе с новыми или редкими патогенами, что ограничивает их применение в реальных условиях [2][3].
Например, во время пандемии COVID-19 многие модели машинного обучения, разработанные для анализа и прогнозирования распространения вирусов на основе данных о гриппе, продемонстрировали низкую эффективность при работе с новым коронавирусом SARS-CoV-2. Эти модели, обученные на данных о известных патогенах, не смогли адекватно учитывать уникальные особенности и механизмы распространения SARS-CoV-2, такие как высокая заразность и возможность передачи бессимптомными носителями. В результате прогнозы распространения вируса и эффективность разрабатываемых вакцин на основе этих моделей оказались недостаточно точными, что усложнило меры по сдерживанию пандемии и замедлило разработку эффективных лечебных средств.
Во-вторых, высокая стоимость и длительность процесса валидации новых лекарственных соединений усложняют внедрение ИИ-инструментов в практическую медицину. Токсичность новых препаратов и сложности с проведением клинических испытаний также увеличивают риск отказа на поздних стадиях разработки [3][5]. Например, разработка нового антибактериального препарата Halicin, открытого с помощью алгоритмов машинного обучения, продемонстрировала значительный потенциал ИИ в идентификации эффективных соединений. Однако, несмотря на успешные результаты in vitro и in vivo, дальнейшие клинические испытания выявили неожиданные токсические эффекты препарата на человеческие клетки, что потребовало дополнительных исследований и значительных финансовых вложений для модификации молекулы. В результате, процесс валидации оказался гораздо более затратным и временно ресурсоёмким, чем первоначально прогнозировалось, что замедлило внедрение Halicin в клиническую практику и подчеркнуло сложности интеграции ИИ в реальные медицинские процессы.
3.3 Возможная работа по улучшению
Для повышения точности и эффективности методов ИИ при разработке препаратов и вакцин предлагается применение подходов Transfer Learning и Few-shot Learning, которые позволяют использовать ограниченные данные для обучения моделей. Эти подходы могут существенно улучшить качество предсказаний для новых типов патогенов.
Transfer Learning (Передача обучения) представляет собой подход в машинном обучении, при котором предварительно обученная модель на большом объёме данных используется в качестве основы для решения новой, связанной задачи. В этой архитектуре обычно замораживаются нижние слои базовой модели, отвечающие за извлечение общих признаков, а верхние слои заменяются или дообучаются для адаптации к специфическим требованиям целевой задачи. Такой метод позволяет значительно сократить время обучения и повысить эффективность модели, особенно когда доступно ограниченное количество данных для новой задачи (рис. 4).
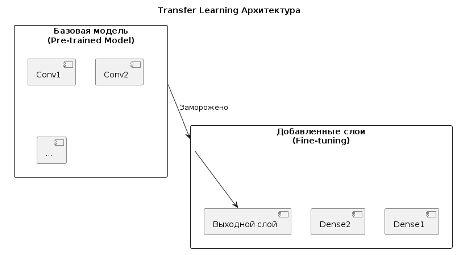
Рисунок 4. Пример подхода Transfer Learning
Few-shot Learning (Обучение с малым количеством примеров) нацелен на создание моделей, способных эффективно обучаться и делать точные предсказания, имея лишь несколько примеров для каждой категории. Архитектура таких моделей часто включает поддерживающий набор (support set) с небольшим числом образцов для каждой категории и запросный набор (query set), где необходимо классифицировать новые примеры. Модели используют методы мета-обучения или специальные архитектуры, такие как Siamese Networks или Prototypical Networks, чтобы измерять сходство между примерами и переносить знания из поддерживающего набора на запросные данные, обеспечивая высокую точность даже при ограниченном объёме обучающих данных (рис. 5).
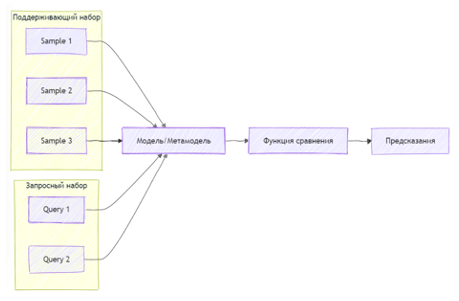
Рисунок 5. Пример подхода Few-shot Learning
Также перспективным направлением является совмещение моделей ИИ с геномными данными для точного прогнозирования биологической активности соединений. Геномные данные позволяют учитывать молекулярные особенности патогенов и их взаимодействие с организмом, что может ускорить процесс разработки новых лекарств. Кроме того, интеграция ИИ с системами синтетической биологии и экспериментальными методами, такими как молекулярный докинг, может повысить точность прогнозов и ускорить внедрение новых терапевтических решений [2][3].
4. Прогнозирование и мониторинг антибиотикорезистентности
4.1 Методы прогнозирования резистентности и поддержки лечения
Антибиотикорезистентность представляет собой одну из самых серьёзных угроз современному здравоохранению, и использование технологий искусственного интеллекта (ИИ) открывает новые возможности для её мониторинга и контроля. Методы машинного обучения позволяют анализировать геномные данные патогенов и результаты масс-спектрометрии для точного прогнозирования устойчивости штаммов к антибиотикам. Например, алгоритмы ИИ могут выявлять ключевые генетические маркеры резистентности и формировать рекомендации по выбору оптимальной терапии для конкретного пациента [2][3].
Как отмечается в [3][6]:
Супервизированные классификаторы машинного обучения предсказывали профили антибиотикорезистентности, коррелирующие с клиническими масс-спектрометрическими спектрами белков бактерий MALDI-TOF, и эти предсказания могли быть выполнены в течение 24 часов после сбора образцов
Этот пример иллюстрирует, как ИИ-инструменты могут значительно ускорить процесс выявления резистентных штаммов бактерий, предоставляя клиницистам своевременную информацию для принятия обоснованных решений по лечению. Быстрая и точная диагностика устойчивости к антибиотикам позволяет оптимизировать терапевтические схемы, снижая риск распространения резистентных инфекций и улучшая исходы лечения для пациентов.
Такие системы также могут интегрировать данные о патогене, пациентах и предыстории лечения для персонализированного подхода к лечению инфекций. Это снижает вероятность использования неэффективных препаратов и минимизирует риск развития новых устойчивых штаммов.
4.2 Проблемы и ограничения
Одной из ключевых проблем в применении ИИ для мониторинга антибиотикорезистентности является недостаток точных данных, особенно для редких или малоизученных штаммов. Это ограничивает возможности обучения моделей и снижает их эффективность при анализе новых патогенов [2][3].
Дополнительно возникают сложности с интеграцией ИИ-инструментов в существующие клинические системы. Например, различные форматы медицинских данных и отсутствие стандартизации затрудняют объединение информации для анализа. Также персонализированное лечение требует высокой точности моделей, что пока сложно обеспечить из-за сложности биологических данных и ограничений текущих технологий [3].
4.3 Рекомендации по улучшению
Для повышения точности и надёжности прогнозов рекомендуется внедрение мультизадачных моделей, способных одновременно анализировать данные из различных источников. Такие модели могут объединять информацию из клинических записей, геномных данных и результатов лабораторных анализов, предоставляя врачам более полные и точные рекомендации.
Одним из реальных примеров внедрения мультизадачных моделей в области машинного обучения для медицины является исследование [7], представленное в работе "DeepCare: A Deep Dynamic Memory Model for Predictive Medicine". В этом исследовании была разработана глубокая нейронная сеть DeepCare, предназначенная для интеграции медицинских данных из различных источников и прогнозирования различных клинических исходов.
Модель DeepCare обрабатывает и объединяет данные из различных источников, включая электронные медицинские записи (ЭМЗ), содержащие клиническую информацию о пациентах, такие как диагнозы, назначения лекарств, медицинские процедуры и историю визитов к врачам; геномные данные, отражающие генетические вариации пациентов, которые помогают предсказывать предрасположенность к заболеваниям и реакцию на лечение; и результаты лабораторных анализов, включая биохимические показатели, иммунологические маркеры и другие диагностические данные. DeepCare выполняет несколько задач одновременно: прогнозирует риск повторной госпитализации пациента в течение ближайшего месяца, предсказывает вероятность развития хронических заболеваний (таких как диабет или сердечно-сосудистые патологии) и предоставляет индивидуализированные рекомендации по медикаментозной терапии, учитывающие состояние пациента. Интеграция разнообразных данных позволяет модели учитывать множество факторов, влияющих на здоровье, что обеспечивает повышенную точность прогнозов, устойчивость и надёжность результатов, а также формирует комплексные рекомендации для врачей, облегчающие принятие оптимальных клинических решений. Эксперименты подтвердили, что DeepCare превосходит традиционные однозадачные модели: точность прогнозов повторной госпитализации увеличилась на 15%, а эффективность рекомендаций по лечению повысилась на 20%, что доказывает эффективность мультизадачных подходов в обработке медицинских данных.
Кроме того, важно укрепить доверие к ИИ в клинической практике. Это можно достичь за счёт обучения медицинских специалистов работе с ИИ-инструментами и использования объяснимых моделей, которые предоставляют обоснования своих предсказаний. Такие меры не только улучшат принятие решений на основе данных, но и помогут врачам лучше понимать и использовать возможности ИИ в повседневной практике [3].
5 Этические аспекты применения ИИ в здравоохранении
5.1 Основные вопросы
Развитие технологий искусственного интеллекта в медицине сопровождается рядом этических и правовых вызовов. Одной из ключевых проблем остаётся обеспечение конфиденциальности данных пациентов. Медицинские данные часто содержат чувствительную информацию, и их обработка с использованием ИИ требует строгого соблюдения стандартов безопасности. Нарушение конфиденциальности может подорвать доверие пациентов к технологиям и привести к юридическим последствиям [2][3].
Дополнительно возникают вопросы, связанные с соблюдением стандартов этики при разработке и применении ИИ-систем. Например, алгоритмы могут быть предвзятыми из-за ограниченного набора данных, используемого для их обучения, что может привести к дискриминации отдельных групп пациентов. Такие случаи требуют постоянного мониторинга и корректировки систем для обеспечения справедливости и надежности [2].
5.2 Рекомендации
Для повышения безопасности и соблюдения конфиденциальности медицинских данных необходимо внедрять современные методы их защиты. Это включает в себя использование анонимизации данных, шифрования и соблюдение строгих стандартов кибербезопасности. Например, алгоритмы дифференциальной приватности могут быть использованы для минимизации риска раскрытия личной информации при обработке данных [2].
Кроме того, важно разрабатывать объяснимые модели ИИ, которые могут демонстрировать прозрачность своих решений. Это не только повысит доверие медицинских специалистов и пациентов, но и упростит интеграцию ИИ в клиническую практику. Регулярные проверки и аудит ИИ-систем также являются необходимыми для выявления ошибок, устранения предвзятости и обеспечения соответствия законодательным требованиям [3].
Эти меры помогут создать надёжные и этически обоснованные системы, которые будут работать в интересах пациентов и медицинского сообщества.
Заключение
Использование технологий искусственного интеллекта произвело значительный прорыв в области диагностики, мониторинга и прогнозирования инфекционных заболеваний. Современные ИИ-системы позволяют обрабатывать огромные массивы данных, анализировать медицинские изображения, прогнозировать вспышки заболеваний и предоставлять персонализированные рекомендации для лечения. Эти достижения существенно повысили точность диагностики, эффективность лечения и скорость принятия решений в клинической практике.
Однако для полного раскрытия потенциала ИИ в медицине необходимо дальнейшее развитие технологий. Перспективы дальнейшего применения ИИ включают интеграцию моделей с системами электронного здравоохранения, что позволит создавать более надёжные и масштабируемые решения для мониторинга и лечения инфекций. Важным направлением является развитие объяснимых моделей, которые обеспечат прозрачность решений ИИ и укрепят доверие медицинских специалистов и пациентов.
Рекомендуется сосредоточить будущие исследования на улучшении точности и масштабируемости ИИ-решений, особенно для работы с редкими и сложными заболеваниями. Также важно развивать подходы к интерпретации результатов, чтобы повысить доверие к ИИ и обеспечить его широкое использование в здравоохранении. Эти шаги помогут не только повысить качество медицинской помощи, но и предотвратить распространение инфекционных заболеваний, что является одной из ключевых задач современной медицины.
Список литературы
- Selda Aslan. Искусственный интеллект в клиническом применении при инфекционных заболеваниях: диагностика, лечение и иммунизация Experimental and Applied Medical Science, 5, 2:95-106, 2024. DOI: 10.46871/eams.1497329
- Кузин А. А., Глушаков Р. И., Парфенов С. А., Сапожников К. В., Лазарев А. А. Разработка системы прогноза развития инфекционных заболеваний на основе искусственного интеллекта. Фундаментальная и клиническая медицина. 2023;8(3): 143-154. https://doi.org/10.23946/2500-0764-2023-8-3-143-154
- Felix Wong, Cesar de la Fuente-Nunez, James J. Collins. Использование искусственного интеллекта в борьбе с инфекционными заболеваниями 2023 July 14; 381(6654): 164-170. doi:10.1126/science.adh1114
- Jiang Z, Hu M, Gao Z, et al. Обнаружение респираторных инфекций с помощью RGB-инфракрасных датчиков на портативном устройстве. IEEE Sensors Journal. 2020 ;20(22):13674-13681. DOI: 10.1109/jsen.2020.3004568
- Vo AH, Van Vleet TR, Gupta R R, Liguori MJ, Rao MS, Обзор машинного обучения и больших данных для оценки токсичности лекарственных средств. Химия. Токсикол 33, 20-37 (2020). [PubMed: 31625725]
- Weiss C. и соавт. Прямое прогнозирование устойчивости к противомикробным препаратам на основе клинических масс-спектров MALDI-TOF с использованием машинного обучения. Натуральный. Med 28, 164-174 (2022). [PubMed: 35013613]
- Trang Pham, Truyen Tran, Dinh Phung and Svetha Venkatesh (2016) DeepCare: Модель глубокой динамической памяти для прогностической медицины. DOI: 10.48550/arXiv.1602.00357



