Сбои в сердечной деятельности влекут за собой серьёзные последствия для всего организма. Для лечения сердечно-сосудистых заболеваний применяются различные лекарственные препараты и постоянно осуществляется разработка новых.
Гетероциклические соединения занимают центральное положение в медицинской химии и представляют особый интерес при поиске новых биоактивных молекул в фармацевтической промышленности. Азотсодержащие гетероциклы, в частности, проявляют разнообразный спектр биологической активности, благодаря их сходству со многими природными и синтетическими молекулами. Имидазольные и бензимидазольные кольца обычно используются в качестве каркасов для разработки терапевтических молекул, представляющих фармацевтический или биологический интерес [1, 2].
Имидазол представляет собой пятичленный ароматический гетероцикл, который широко присутствует в важных биологических соединениях, таких как аминокислота гистидин (нормальная составляющая большинства белков), гистамин, пурины и биотин.
Считается, что интерес к химии бензимидазола и его роли в качестве основы для открытия и разработки лекарственных препаратов возник в связи с открытием редкого и наиболее известного соединения бензимидазола в природе, N-рибозил-диметил-бензимидазола, который является аксиальным лигандом в витамине В12.
Бензимидазолы имеют структуру, напоминающую встречающиеся в природе пуриновые нуклеотиды, что позволяет им легко превращаться в биополимеры в живой системе [3]. Это чрезвычайно мощные вещества, обладающие как высоким уровнем ингибирующей активности, так и благоприятным коэффициентом селективности. Они представляют собой важный класс органических соединений, которые встречаются во многих натуральных продуктах и входят в состав большого количества лекарственных препаратов, таких как Биластин (препарат от крапивницы), Эмедастин (аллергический конъюнктивит), Клемизол (зуд) [4].
Бензимидазольная группа найдена в многочисленных терапевтических средствах, включая противоопухолевые [5], противомикробные препараты [6], антиоксиданты [7], противовирусные препараты [8], ингибиторы протонной помпы [9], противопаразитарные средства [10], противовоспалительные средства [11], гипотензивные средства [12], антикоагулянты [13], иммуномодуляторы [14], стимуляторы ЦНС, а также депрессанты [15,16] и противодиабетические средства.
Целью настоящего исследования было изучение влияния 1H-бензимидазол-1-ил-метанола и его прекурсора бензимидазола на функциональное состояние сердца крысы. Ранее нами исследовалось биологическое действие растворов 1H-бензимидазол-1-ил-метанола разной концентрации.
Условия и методы исследования
Исследования проводили в хронических опытах на 18 нелинейных половозрелых самцах крыс массой 200 – 250 г., наркотизированных уретаном.
У всех животных регистрировали электрокардиограмму (ЭКГ) на фоне действия исследуемого соединения через 5, 10, 15, 20, 25, 30, 35, 40 и 45 минут. Для изучения его биологического действия применяли концентрацию вещества 10-2 М. Раствор вещества вводили внутрибрюшинно в объеме 1 мл.
В экспериментах определялось влияние вещества на основные параметры ЭКГ: продолжительность зубца P, интервалов R-R, Р-Q, Q-T и комплекса QRS, а также частоту сердечных сокращений (ЧСС).
Запись ЭКГ проводили на электрокардиографе Альтон – 03М2 при помощи стальных игольчатых электродов во втором стандартном отведении.
По динамике колебаний временных и амплитудных параметров кривой электрической активности сердечной мышцы судили о кардиотропных свойствах исследуемого соединения.
Результаты экспериментов были подвергнуты статистической обработке с применением критерия Стьюдента. Все данные представлены как средние значения ± стандартные ошибки. Для построения графиков был использован программный пакет SigmaPlot. Статистически значимыми считались изменения со значениями: * – р<0,05; ** – р<0,01; *** – р<0,001.
Результаты и их обсуждение
Анализ ЭКГ, зарегистрированных при введении 10-2 М раствора 1H-бензимидазол-1-ил-метанола, позволил выявить характерные изменения амплитудных и временных параметров.
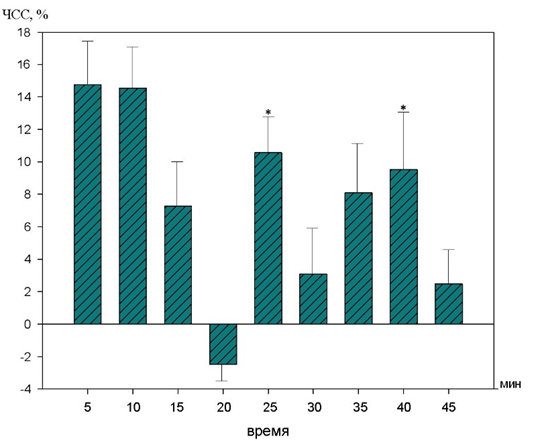
Рис.1. Динамика изменений частоты сердечных сокращений на фоне действия 10-2 М, раствора 1H–бензимидазол–1–ил–метанола (в %% от исходного уровня).
Частота сердечных сокращений имела тенденцию увеличиваться, статистически значимые изменения зарегистрированы только на 25 и 40 минутах и составили 11,1±2,1% (p<0,05), 9,2±1,9% (p<0,05) соответственно (рис. 1).
На рисунке 2 показаны изменения продолжительности интервала R-R.
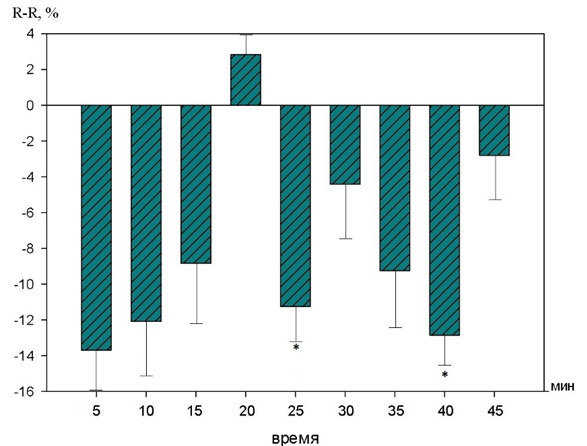
Рис. 2. Динамика изменений интервала R-R на фоне действия 10-2 М раствора1H–бензимидазол–1–ил–метанола (в %% от исходного уровня).
При введении 1H–бензимидазол–1–ил–метанола в концентрации10-2 М интервал R-R уменьшался. Статистически значимые изменения наблюдались на 25 и 40 минутах и составили 11,4±2,5% (p<0,05), 13,6±2,2% (p<0,05) соответственно.
На рисунке 3 показаны изменения продолжительности интервала P-Q.
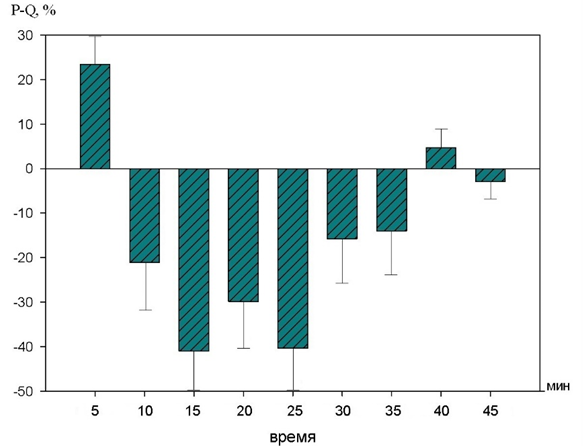
Рис. 3. Динамика изменений интервала P-Q на фоне действия 10-2 М раствора 1H–бензимидазол–1–ил–метанола (в %% от исходного уровня).
На фоне действия 10-2 М раствора 1H–бензимидазол–1–ил–метанола статистически значимых изменений не выявлено.
На рисунке 4 показаны изменения продолжительности интервала Q-T.
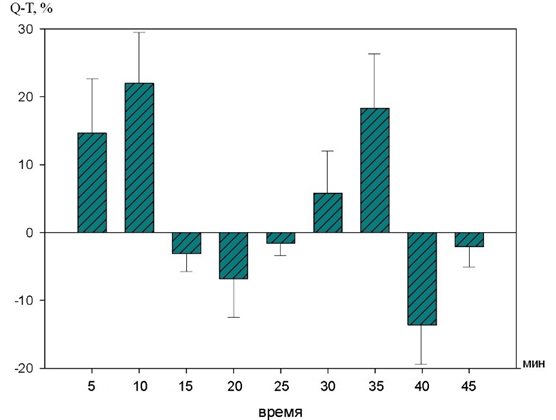
Рис. 4. Динамика изменений интервала Q-T на фоне действия 10-2 М раствора 1H–бензимидазол–1–ил–метанола (в %% от исходного уровня).
На фоне действия 10-2 М раствора 1H–бензимидазол–1–ил–метанола статистически значимых изменений не выявлено.
На рисунке 5 показаны изменения продолжительности зубца P.
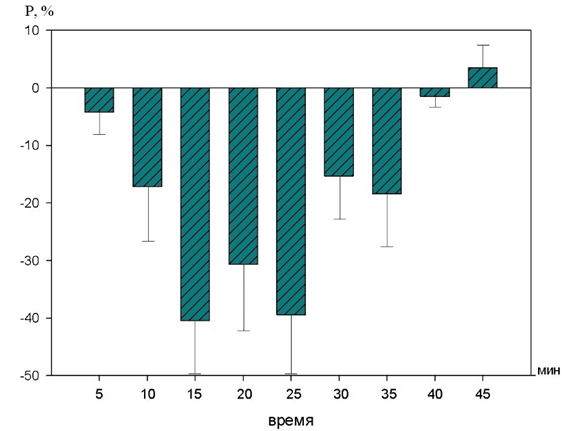
Рис. 5. Динамика изменений продолжительности зубца Р на фоне действия 10-2 М раствора 1H–бензимидазол–1–ил–метанола (в %% от исходного уровня).
При введении вещества в концентрации 10-2М изменения продолжительности зубца Р не достигали статистически значимых изменений.
На рисунке 6 показаны изменения продолжительности комплекса QRS.
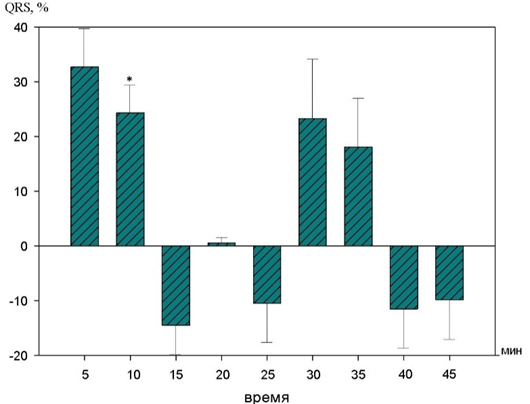
Рис. 6. Динамика изменений комплекса QRS на фоне действия 10-2 М раствора1H–бензимидазол–1–ил–метанола (в %% от исходного уровня).
На фоне действия 10-2 М раствора 1H–бензимидазол–1–ил–метанола продолжительность комплекса QRS имела тенденцию к увеличению и достигла статистически значимых изменений на 10 минуте, которые составили 26,9±19,4% (p<0,05).
В следующих сериях экспериментов изучались кардиотропные эффекты прекурсора исследуемого соединения - бензимидазола, раствор которого тестировался в концентрации 10-2 М.
Были выявлены следующие изменения ЧСС (рис. 7).
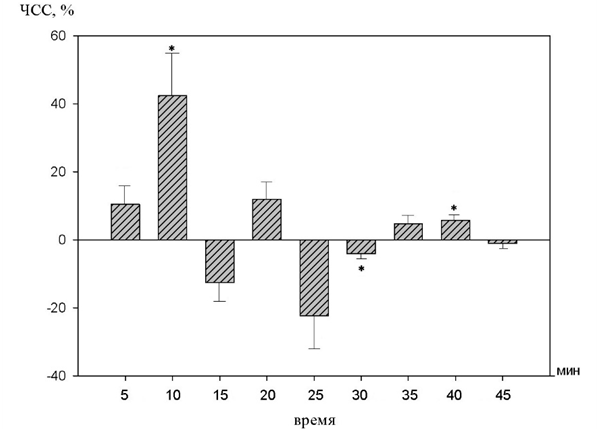
Рис.7. Динамика изменений частоты сердечных сокращений на фоне действия 10-2 М раствора бензимидазола (в %% от исходного уровня).
При введении 10-2 М раствора бензимидазола ЧСС имела тенденцию, как к увеличению, так и к уменьшению, однако, статистически значимые изменения были зарегистрированы на 10, 30 и 40 минутах и составили 43,4±7,8% (p<0,05), 5,2±1,7% (p<0,05) и 8,3±3,4%(p<0,05) соответственно.
На рисунке 8 показаны изменения продолжительности интервала R-R.
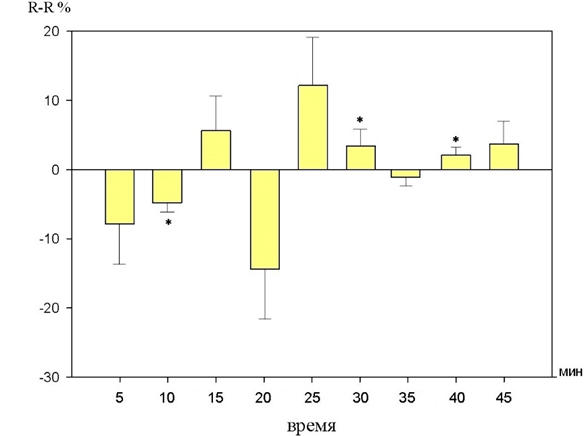
Рис. 8. Динамика изменений интервала R-R на фоне действия 10-2 М раствора бензимидазола (в %% от исходного уровня).
При введении бензимидазола в концентрации10-2 М интервал R-R имел тенденцию, как к уменьшению, так и к увеличению. Статистически значимые изменения наблюдались на 10, 30 и 40 минутах и составили 7,4±2,6% (p<0,05), 5,6±4,2% (p<0,05)и 3,1±2,8% (p<0,05) соответственно.
На рисунке 9 показаны изменения продолжительности интервала P-Q.
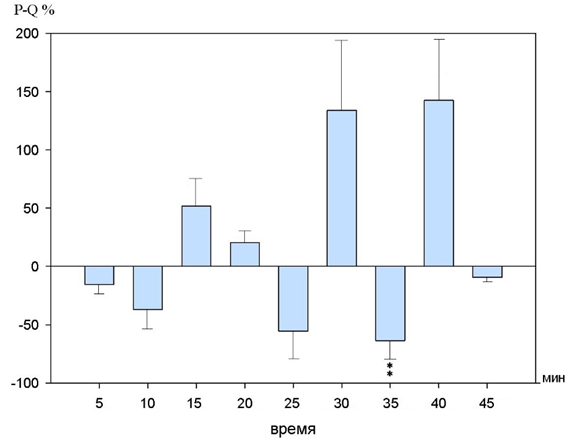
Рис.9. Динамика изменений интервала P-Q на фоне действия 10-2 М раствора бензимидазола (в %% от исходного уровня).
Интервал P-Q имел тенденцию к уменьшению, однако статистически значимых изменений достиг только на 35 минуте и составил 69,8±4,3% (p<0,01) по сравнению с исходным уровнем.
На рисунке 10 показаны изменения продолжительности интервала Q-T.
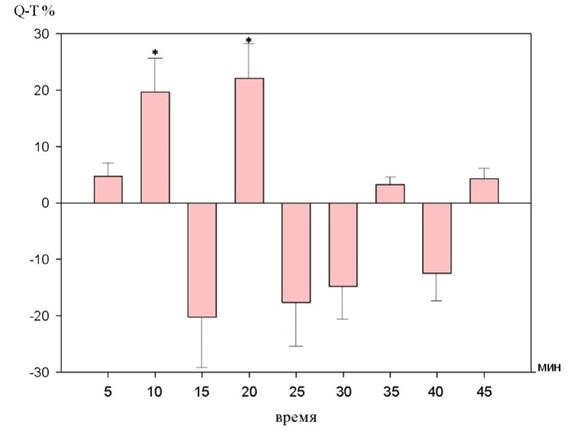
Рис. 10. Динамика изменений интервала Q-T на фоне действия 10-2 М раствора бензимидазола (в %% от исходного уровня).
Статистически значимое увеличение интервала Q-T наблюдались на 10 и 20 минутах. Изменения составили 19,1±7,7% (p<0,05) и 22,2±5,9% (p<0,05) соответственно.
На рисунке 11 показаны изменения продолжительности зубца P.
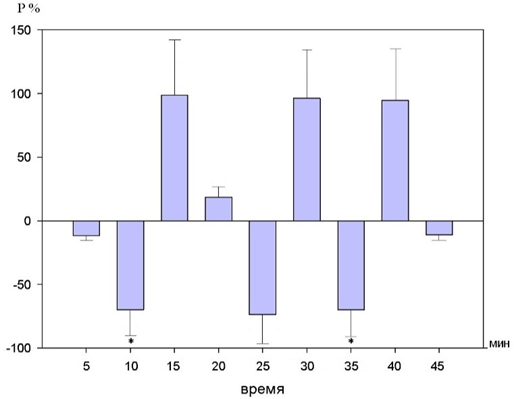
Рис. 11. Динамика изменений продолжительности зубца Р на фоне действия 10-2 М раствора бензимидазола (в %% от исходного уровня).
При введении вещества в концентрации 10-2 М статистически значимое уменьшение данного параметра было достигнутона 10 и 35 минутах и составило 72,3±7,4% (p<0,05) и 78,7± 6,3%(p<0,05).
На рисунке 12 показаны изменения продолжительности комплекса QRS.
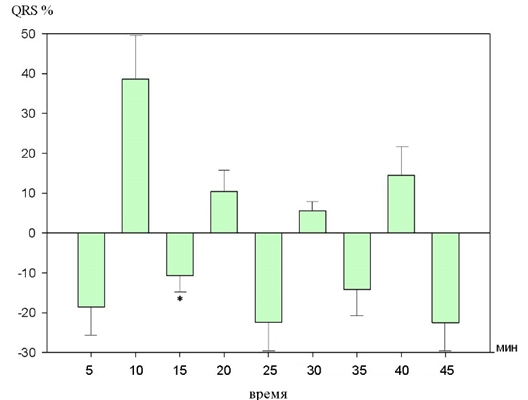
Рис. 12. Динамика изменений комплекса QRS на фоне действия 10-2 М раствора бензимидазола (в %% от исходного уровня).
На 15 минуте отмечалось статистически значимое уменьшение данного параметра на 12,9±9,4% (p<0,05).
Обсуждение полученных результатов
Анализ экспериментальных данных, полученных при изучении влияния 1H–бензимидазол–1–ил–метанола и его прекурсора бензимидазола на функциональное состояние сердца крыс, позволил выявить изменения основных параметров ЭКГ.
При введении исследуемых соединений в концентрации 10-2 М наблюдалась тенденция к увеличению частоты сердечных сокращений и уменьшению интервала R-R, который отражает продолжительность сердечного цикла. Это свидетельствует о развивающейся на фоне действия веществ тахикардии.
При действии 1H–бензимидазол–1–ил–метанола в концентрации 10-2 М продолжительность комплекса QRS увеличивалась, а при действии бензимидазола в той же концентрации - уменьшалась. Таким образом, модификация молекулы бензимидазола приводит к появлению у его химического производного способности замедлять процесс деполяризации желудочков сердца, что может указывать на блокаду ножки пучка Гиса или на замедление внутрижелудочковой проводимости. С другой стороны, укорочение комплекса QRS при действии бензимидазола может вызвать электрическую нестабильность миокарда, которая впоследствии может привести к развитию желудочковых аритмий.
Укорочение интервала P-Q при действии бензимидазола может указывать на задержку проведения импульса или свидетельствует о синдроме Вольфа-Паркинсона-Уайта (синдром WPW). Тенденция учащения ЧСС в сочетании с уменьшением продолжительности интервала P-Q может свидетельствовать о развитии синусовой тахикардии.
Поскольку, P-волна отражает деполяризацию предсердий, укорочение продолжительности зубца Р при действии бензимидазола указывает на уменьшение времени передачи возбуждения с правого предсердия на левое.
Интервал QT отражает временной промежуток между началом деполяризации желудочков и окончанием их реполяризации. Удлинение этого интервала при действии бензимидазола приводит к ранней постдеполяризации и пространственной дисперсии желудочковой рефрактерности, что может вызвать появление аритмии.
Довольно сложно говорить о возможных механизмах вмешательства исследованных химических соединений в деятельность сердца в условиях целостного организма. Реакция сердечно-сосудистой системы является интегративным ответом как на прямое действие веществ на сократительный миокард и проводящую систему сердца, так и на опосредованное - через рефлекторные и гуморальные механизмы влияния на сердце и сосуды.
Заключение
Таким образом, в данном исследовании было продемонстрировано, что 1H–бензимидазол–1–ил–метанол и бензимидазол оказывают преимущественно негативное влияние на функциональное состояние сердца крысы, на что указывают характерные изменения параметров электрокардиограммы.
Список литературы
- Gaba M, Mohan C. Development of drugs based on imidazole and benzimidazole bioactive heterocycles: Recent advances and future directions. Medicinal Chemistry Research. 2016; 25:173-210
- Keri RS, Hiremathad A, Budagumpi S, Nagaraja BM. Comprehensive review in current developments of benzimidazole-based medicinal chemistry. Chemical Biology & Drug Design. 2015; 86:19-65.
- Shrivastava N, Naim MJ, Alam MJ, Nawaz F, Ahmed S, Alam O. Benzimidazole scaffold as anticanceragent: Synthetic approaches andstructure-activity relationship. Archivder Pharmazie. 2017; 350:1-80.e1700040.
- Yadav G, Ganguly S. Structure activity relationship (SAR) study of benzimidazole scaffold for different biological activities: A mini-review. European Journal of Medicinal Chemistry. 2015; 97:419-443.
- De Simone RW, Currie KS, Mitchell SA, Darrow JW, Pippin DA. Privileged structures: Applications in drug discovery. Combinatorial Chemistry &High Throughput Screening. 2004; 7:473-494
- Gaba M, Singh S, Mohan C. Benzimidazole: An emerging scaffold for analgesic and anti-inflammatory agents. European Journal of Medicinal Chemistry. 2014; 76:494-505.
- Barker HA, Smyth RD, Weissbach H, Toohey JI, Ladd JN, Volcani BE. Isolation and properties of crystalline cobamide coenzymes containing benzimidazole or 5,6-dimethylbenzimidazole. The Journal of Biological Chemistry. 1960; 235:480-488
- Cheson BD, Brugger W, Damaj G, Dreyling M, Kahl B, Kimby E, et al. Optimal use of bendamustinein hematologic disorders: Treatment recommendations from an international consensus panel—An update. Leukemia& Lymphoma. 2016; 57:766-782.
- Cheson BD, Rummel MJ. Bendamustine: Rebirth of an old drug. Journal of Clinical Oncology. 2009; 27:1492-1501.
- Tageja N, Nagi J. Bendamustine: Something old, something new. Cancer Chemotherapy and Pharmacology.2010; 66:413-423.
- Njar VC, Brodie AM. Discovery and development of Galeterone (TOK-001or VN/124-1) for the treatment of all stages of prostate cancer. Journal of Medicinal Chemistry. 2015; 58:2077-2087.
- Nicolle A, Proctor SJ, Summerfield GP. High dose chlorambucil in the treatment of lymphoid malignancies. Leukemia & Lymphoma. 2004; 45:271-275
- Ozegowski W, Krebs D. IMET 3393,([1-methyl-5-bis-(chloroethyl)-amino-benzimidazolyl-(2)]-butyric)acid hydrochloride, a new cytostatic agent from among the series of benzimidazole mustard compounds. Zentralblattfür die Pharmazie. 1971; 110:1013-1019
- Knauf WU, Lissichkov T, Aldaoud A, Liberati A, Loscertales J, Herbrecht R, et al. Phase III randomized study of bendamustine compared with 10 Benzimidazole and Its Derivatives chlorambucil in previously untreated patients with chronic lymphocyticleukemia. Journal of Clinical Oncology. 2009; 27:4378-4384.
- Rasschaert M, Schrijvers D, Van den Brande J, Dyck J, Bosmans J, Merkle K, et al. A phase I study of bendamustine hydrochloride administered once every3 weeks in patients with solid tumors. Anti-Cancer Drugs. 2007; 18:587-595
- Rasschaert M, Schrijvers D, Van den Brande J, Dyck J, Bosmans J, Merkle K, et al. A phase I study of bendamustine hydrochloride administered day 1+2every 3 weeks in patients with solid tumours. British Journal of Cancer. 2007; 96:1692-1698.



