Легочный фиброз – это хроническое прогрессирующее заболевание легких, характеризующееся утолщением фиброзных стенок альвеол, приводящее к нарушению газообмена, ограничению режима вентиляции и, как следствие, дыхательной недостаточности [1,2]. Легочный фиброз представляет собой гетерогенное заболевание, характеризующееся отчетливым паттерном тканевой патологии и включающее большое количество хронических респираторных патологий, сопровождающихся ростом соединительной ткани в различных отделах легких, среди которых интерстициальные заболевания легких (ИЗЛ) и идиопатический легочный фиброз (ИЛФ) являются наиболее тяжелыми и необратимыми с прогрессирующим фиброзированием легочной паренхимы [3,4,5,6]. Смертность и заболеваемость легочным фиброзом продолжают расти из-за постоянного совершенствования методов диагностики, а также старения населения и на сегодняшний день составляют около 10 случаев на 100 000 населения при ИЛФ и 19,4 случая на 100 000 населения при ИЗЛ [7,8]. Прогрессирование заболевания может отличаться от пациента к пациенту в зависимости от возраста и пола [9], микробиома легких [10], генетических факторов и факторов окружающей среды [11]. В общей сложности 5-летняя выживаемость пациентов с ИЛФ составляет от 20 до 40%, в то время как медиана выживаемости колеблется от 2 до 5 лет [12], а общая 5-летняя выживаемость пациентов с ИЗЛ колеблется в среднем от 55 до 75% [13,14].
Как правило, развитию легочного фиброза часто предшествует острое воспаление легких, вызванное вирусными и бактериальными инфекциями, ионизирующей радиацией, химиотерапией, раздражителями воздуха и загрязняющими веществами [15,16,17,18], которые не были устранены вовремя и привели к отложению фиброзной ткани в легких и дыхательной дисфункции [3]. Следует отметить, что этиология ИЛФ неизвестна [19], но среди многих внутренних и внешних факторов риска вирусные инфекции [20], связанная с гастроэзофагеальной рефлюксной болезнью (ГЭРБ) микро-аспирация [21], генетическая предрасположенность [22,23]. Одним из заслуживающих внимания факторов риска развития ИЛФ является ГЭРБ. Это одно из наиболее распространенных заболеваний у пациентов с легочным фиброзом, поражающее почти 87% пациентов, но причинно-следственная связь между легочным фиброзом и ГЭРБ пока не ясна и остается перспективной темой для будущих исследований [24,25]. Следует также отметить, что ряд авторов постулируют сложность взаимодействий между сосуществующими ИЛФ/ИЗЛ и заболеванием COVID-19 [26,27]. Обычно симптомы легочного фиброза включают одышку, непродуктивный кашель, потерю веса и усталость в результате гипоксии [28].
Текущая патогенетическая модель ИЛФ предполагает, что фиброз легких развивается в результате непрекращающегося воспаления в сочетании с генетическими факторами и факторами риска, связанными со старением альвеолярных эпителиальных клеток типа I / II (AECI I/II), которые последовательно запускают аномальную реакцию заживления повреждения посредством активации фибробластов и миофибробластов и замещение поврежденного альвеолярного эпителия фиброзной рубцовой тканью из-за снижения способности альвеолярного эпителия к обновлению [30,31,32]. Так называемые очаги фибробластов, расположенные субэпителиально, представляют собой активные очаги фиброза и состоят из устойчивых к апоптозу миофибробластов и продуцируемого ими внеклеточного матрикса (ECM), что приводит к стойкому отложению коллагена, прогрессирующему рубцеванию и общему снижению эластичности легочной ткани [30,33]. Другим признаком ИЛФ является альвеолоэктазы, включающие структуры, состоящие из базальных клеток бронхиол и секреторных клеток дыхательных путей, продуцирующих муцин [34,35,36]. Кроме того, широко наблюдалось, что эпителий дыхательных путей, состоящий из p63 + цитокератин-5 / KRT5 + положительных слоев базальных клеток (под мерцательным эпителием), покрывает очаги фибробластов, что указывает на то, что целостность альвеолярного эпителия серьезно нарушена при ИЛФ [34,37]. В связи с этим, гибель альвеолярных эпителиальных клеток II типа является характерной особенностью ИЛФ [32,38,39,40,41] и связана со стрессом эндоплазматического ретикулума (ЭПР), поскольку различные исследования задокументировали индукцию развернутого белкового ответа (UPR) и маркеров проапоптотического ЭПР-стресса у альвеолярных эпителиальных клеток II типа пациентов со спорадическими и семейными ИЛФ [42,43,44,45].
На сегодняшний день два препарата для терапии легочного фиброза – пирфенидон и нинтеданиб были одобрены FDA. Пирфенидон, относящийся к классу пиридинов, проявляет противовоспалительные, антиоксидантные и антифибротические свойства посредством регуляции нескольких ключевых про-фиброзных молекул, таких как TGF-β, PDGF, а также прямого изменения экспрессии коллагена [46]. В клинических испытаниях лечение пирфенидоном привело к заметному улучшению динамики форсированной жизненной емкости легких (ФЖЕЛ) у пациентов с легочным фиброзом [47,48]. Было обнаружено, что нинтеданиб, ингибитор тирозинкиназы, подавляет пролиферацию и дифференцировку фибробластов [49,50]. В клинических испытаниях II и III фазы терапия нинтеданибом привела к значительному улучшению функции легких у пациентов с легочным фиброзом. Кроме того, нинтеданиб эффективен у пациентов с прогрессирующим фиброзом легких с минимальными побочными эффектами [51,52].
Пациент М поступил в 1 клинику терапии усовершенствования врачей Военно-медицинской академии им. С.М. Кирова с жалобами на одышку, возникающую при привычной физической нагрузке. Оценивая объективный статус обращали на себя внимание симптом барабанных палочек и часовых стекол, сатурация на атмосферном воздухе 92%. Со слов пациента и согласно данным представленной медицинской документации, считает себя больным с ноября 2021 г., когда впервые обнаружил образование поднижнечелюстной области справа, по поводу чего обратился в поликлинику по месту жительства, откуда был направлен к челюстно-лицевому хирургу. С ноября по декабрь 2021 г. проходил амбулаторное лечение у челюстно-лицевого хирурга. На фоне санации ротовой полости, проводимой антибактериальной терапии наблюдалось увеличение образования в размерах, в связи с чем была рекомендована биопсия лимфатического узла.
В январе 2022 г. был госпитализирован в клинику челюстно-лицевой хирургии Военно-медицинской академии им. С.М. Кирова, где была выполнена эксцизионная биопсия поднижнечелюстного лимфатического узла справа. Гистологическое и иммуногистохимическое исследование правого поднижнечелюстного лимфатического узла справа показало гистологическую картину лимфопролиферативного заболевания. При ИГХ-исследовании: CD20 - интенсивная мембранная реакция В-клеток, CD21 - гетерогенная по интенсивности мембранная реакция в фолликулярных клетках, CD30 - окрашивание клеточной мембраны и аппарата Гольджи в клетках опухоли, CD3 - интенсивная мембранная реакция в Т-клетках диффузных областей, CD23 - выраженная по интенсивности реакция в фолликулярных клетках, CycD1 - гетерогенная по интенсивности реакция в фолликулярных клетках, Ki-67 - 50%. Заключение: данные иммунофенотипа соответствуют классической лимфоме Ходжкина с лимфоидным истощением.
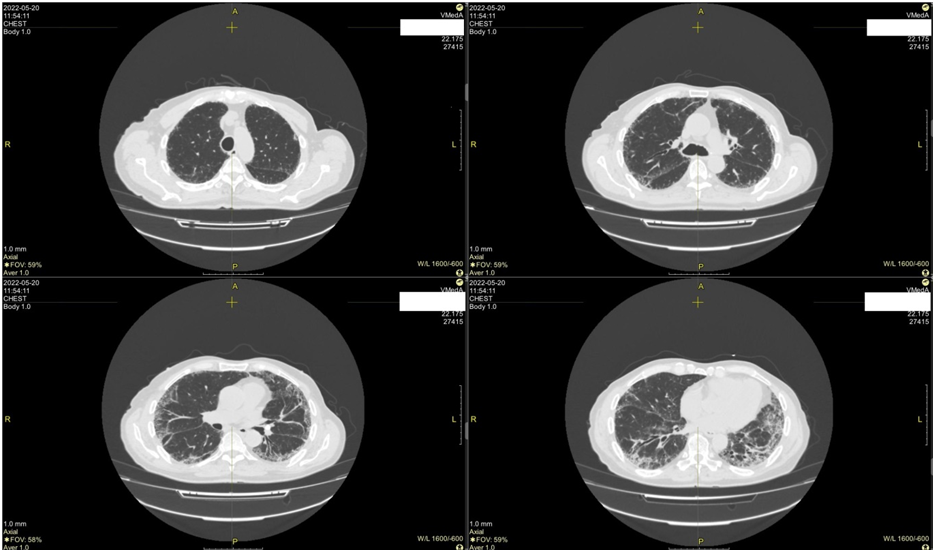
С 27.01 по 02.02.2022 г. проходил стационарное обследование и лечение в клинике факультетской терапии Военно-медицинской академии им. С.М. Кирова, где было выполнено КТ шеи, груди, живота, таза 28.01.2022 г.: КТ-картина лимфаденопатии узлов правых подчелюстной, верхней и средней яремных групп. Солидный очаг S1 правого легкого (Lung-RADs 2). Кальцинат S6 левого легкого. Петрификаты лимфатических узлов левой бронхопульмональной группы. Гистологическое исследование костного мозга от 28.01.2022 г.: признаки поражения костного мозга не обнаружены. На основании полученных данных был установлен окончательный диагноз: Классическая лимфома Ходжкина, вариант с лимфоидным истощением c экспрессией СD20 IA стадии с поражением правых подчелюстных, правых верхних и средних яремных лимфатических узлов (24.01.2022 г.) IPS-3. ECOG 0. В период с 31.01.2022 г. инициирован первый курс полихимиотерапии по протоколу «R-ABVD», перенес удовлетворительно. В конце февраля 2022 г. пациент заболел новой коронавирусной инфекцией, инициация второго курса полихимиотерапии была перенесена до выздоровления. Новую коронавирусную инфекцию перенес в легкой форме, 21.03.2022 г. был получен отрицательный ПЦР SARS-CoV-2. С 22.03.2022 г. инициирован второй курс полихимиотерапии по протоколу «R-ABVD», введение препаратов в первый день перенес удовлетворительно. 05.04.2022 г. выполнен ПЦР тест на SARS-CoV-2, получен положительный результат, в связи с чем введение препаратов на 15 день второго курса было отсрочено до получения отрицательного мазка. 11.04.2022 г. получен отрицательный ПЦР-тест. 11.04.2022 г. выполнил ПЭТ-КТ тела: признаков активности лимфопролиферативного заболевания не выявлено. Воспалительные изменения в лёгких и внутригрудных лимфоузлах, вероятнее, вирусной этиологии. На основании данных ПЭТ-КТ верифицирована ПЭТ-КТ негативная ремиссия. С 29.04.2022 г. инициирован третий курс по протоколу «ABVD», введение препаратов перенес удовлетворительно. После перенесенной новой коронавирусной инфекции пациент отмечает появление выраженной одышки при минимальной физической нагрузке. В связи с впервые появившимися жалобами, пациент был госпитализирован в клинику факультетской терапии Военно-медицинской академии им. С.М. Кирова на отделение кардиологии, где находился на стационарном лечении с 18.05 по 06.06.2022 г. с диагнозом: ИБС. Стенокардия напряжения I ФК. Гипертоническая болезнь II ст., медикаментозная нормотензия, риск ССО 3. Атеросклероз аорты. Атеросклеротический кардиосклероз. ХСН IIА ст., 2 ФК по NYHA. С целью дифференциальной диагностики сердечной и легочной одышки, пациенту была выполнена КТ груди с контрастированием от 20.05.2022 г.: данных за ТЭЛА и ее крупных ветвей не выявлено. КТ-признаки интерстициальных изменений в легких, которые следует дифференцировать между неспецифической интерстициальной пневмонией по фибротическому типу на фоне последствий вирусной пневмонии (с учетом анамнеза) и идиопатическим легочным фиброзом (изменения наиболее выражены в нижних долях с уменьшением их объема). (рис 1)
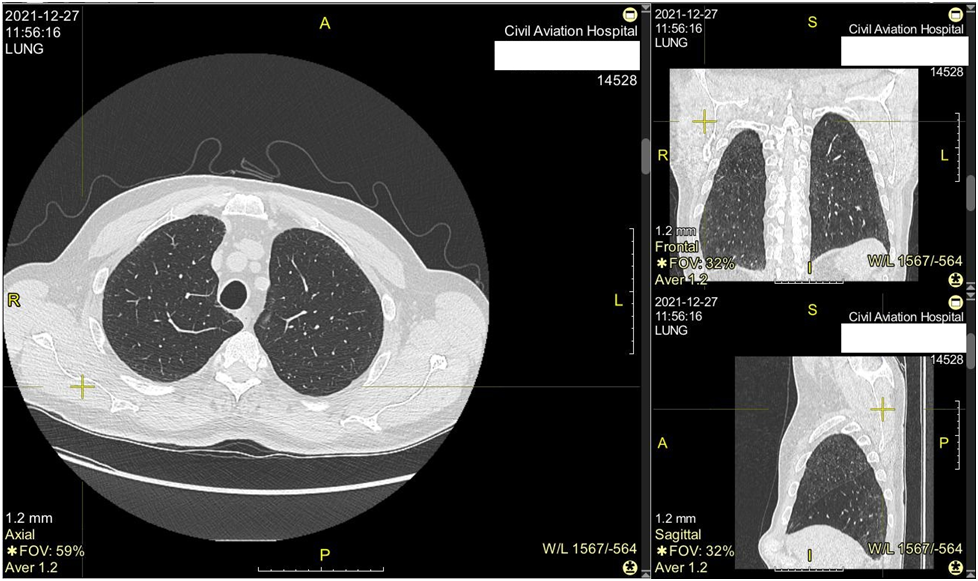
Следует отметить, что в 2021 году пациенту была выполнена СКТ груди, по данным которой отмечались фиброзные изменения в кортикальных отделах обоих легких, что могло свидетельствовать о развитии самостоятельного фиброзирующего заболевания легочной ткани. (рис 2)
Пациент был консультирован пульмонологом, с учетом полученных данных установлен диагноз: Идиопатический легочный фиброз. Эмфизема легких. Дыхательная недостаточность I степени. Был рекомендован прием таб. Метилпреднизолон 4 мг (2 таб. утром + 1 таб. в обед) на протяжении 1 месяца; таб. Пентоксифиллин 200 мг по 1 таб. 3 раза в день. Для оценки проводимой терапии пациент был госпитализирован повторно на кафедру факультетской терапии ВМедА им. С.М. Кирова с 07.07 по 12.07.2022 г., при КТ груди от 07.07.2022 г.: КТ-картина интерстициально-фиброзных изменений легких, вероятно, вследствие разрешения двусторонней полисегментарной пневмонии, однако нельзя исключить паттерн обычной интерстициальной пневмонии. При сравнении с СКТ от 20.05.2022 г. отмечается минимальная положительная динамика в виде уменьшения отека внутри и междолькового интерстиция и степени интенсивности зон по типу матового стекла. Повторно консультирован пульмонологом. Было рекомендовано: постепенная отмена таб. Метилпреднизолон 4 мг (2 таб. + 1 таб.) по ½ таб. через день начиная с обеденной дозы до полной отмены препарата; свечи Лонгидаза 3000 МЕ по 1 свече 1 раз в сутки с интервалом в 2-3 дня в течении 21 дня. На фоне проводимой терапии положительного эффекта не наблюдалось.
В процессе госпитализации с учетом аускультативной (треск целлофана) картины, прогрессирующей дыхательной недостаточности, значительного снижения альвеолярного объема, положительного теста с 6 минутной ходьбой, увеличения объема и характера фиброзного поражения лёгочной ткани с вовлечением в патологический процесс апикальных и задне-базальных отделов и увеличения количества тракционных бронхоэктазов, вероятным диагнозом является идиопатический легочный фиброз. Было отмечено, что рентгенологические паттерны соответствуют вероятной ОИП, что требует решения вопроса о проведении ВТС с последующей гистологической верификацией. Однако, учитывая возраст пациента, сопутствующие заболевания со стороны сердечно-сосудистой (ИБС, стенокардия) системы, лимфопролиферативное заболевание, курсов химиотерапии, рекомендовано инициировать антифибротическую терапию без гистологической верификации. С учетом вышеперечисленного и мнения специалистов, была инициирована антифибротическая терапия: т. Нинтеданиб 150 мг 2 раза в день с последующей оценкой эффективности проводимой терапии с помощью контрольных лучевых методов исследования (СКТ груди) через 6 месяцев. С целью улучшения вентиляционной способности лёгких, и возможного антифибротического эффекта олодатерола, принято решение о назначение бронхолитической терапии комбинированным препаратом через систему SMI Тиотропия бромид + Олодатерол (Спиолто Респимат) 2,5 мкг +2,5 мкг по 2 вдоха 1 раз в день утром.
Список литературы
- De Matteis S., Murgia N. Work-related interstitial lung disease: What is the true burden? Int. J. Tuberc. Lung Dis. 2022;26:1001–1005
- Dwyer D.N.O., Ashley S.L., Gurczynski S.J., Xia M., Wilke C., Falkowski N.R., Norman K.C., Arnold K.B., Huffnagle G.B., Salisbury M.L., et al. Lung Microbiota Contribute to Pulmonary Inflammation and Disease Progression in Pulmonary Fibrosis. Am. J. Respir. Crit. Care Med. 2019;199:1127–1138.
- Denham J.W., Hauer-Jensen M. The radiotherapeutic injury—A complex “wound” Radiother. Oncol. 2002;63:129–145.
- Kelly B.G., Lok S.S., Hasleton P.S., Egan J.J., Stewart J.P. A rearranged form of Epstein-Barr virus DNA is associated with idiopathic pulmonary fibrosis. Am. J. Respir. Crit. Care Med. 2002;166:510–513.
- Bédard Méthot D., Leblanc É., Lacasse Y. Meta-analysis of Gastroesophageal Reflux Disease and Idiopathic Pulmonary Fibrosis. Chest. 2019;155:33–43.
- Richeldi L., Collard H.R., Jones M.G. Idiopathic pulmonary fibrosis. Lancet. 2017;389:1941–1952.
- Plantier L., Crestani B., Wert S.E., Dehoux M., Zweytick B., Guenther A., Whitsett J.A. Ectopic respiratory epithelial cell differentiation in bronchiolised distal airspaces in idiopathic pulmonary fibrosis. Thorax. 2011;66:651–657.
- Barbas-Filho J.V., Ferreira M.A., Sesso A., Kairalla R.A., Carvalho C.R., Capelozzi V.L. Evidence of type II pneumocyte apoptosis in the pathogenesis of idiopathic pulmonary fibrosis (IFP)/usual interstitial pneumonia (UIP) J. Clin. Pathol. 2001;54:132–138.
- Klymenko O., Huehn M., Wilhelm J., Wasnick R., Shalashova I., Ruppert C., Henneke I., Hezel S., Guenther K., Mahavadi P., et al. Regulation and role of the ER stress transcription factor CHOP in alveolar epithelial type-II cells. J. Mol. Med. 2019;97:973–990.
- Hilberg F., Roth G.J., Krssak M., Kautschitsch S., Sommergruber W., Tontsch-Grunt U., Garin-Chesa P., Bader G., Zoephel A., Quant J., et al. BIBF 1120: Triple angiokinase inhibitor with sustained receptor blockade and good antitumor efficacy. Cancer Res. 2008;68:4774–4782.



