Атом- это один из самых необычных субъектов физической науки. Наиболее известную нам теорию атома, которую в основных сведениях западные научные сотрудники принимали с 1600-х до 1900-х годов, появилась еще у афинских философов в 6 веке до нашей эры. Их начальные домыслы говорили о том, что атом представляет собой прочную, неделимую основу частицы природы. Мы уже изучили первоначальное упоминание атома во взгляде Демокрита. Но Платон и его последователь Аристотель осуждали концепцию атома, в большей мере на философских началах. Афинское суждение об атоме важно и исторически и философски, но оно не обладает никакой ценностью науки. Оно не являлось основанным на природных наблюдениях, замерах или опытах. При этом даже со стороны философской науки появлялись конфликты по данному поводу. В философских трудах Демокрита атомы существовали не только для материи, но и для человеческой сущности. Кислоту создавали атомы в виде острого стержня, в тот момент как светлый цвет состоял из атом с ровной поверхностью. Душевные атомы считались очень хрупкими. Демокрит формировал свою атомистическую науку как прослойку между двумя различными афинскими концепциями о действительности и фантазии. В средневековой христианской Европе значимостью обладала именно теория Аристотеля- наука развивалась на предании и разуме, а римские верующие полностью игнорировали Демокрита как материалиста и атеиста. Аристотель считал, что вакуум отсутствует, потому что не видел тела, которые падают со скоростью через пространство. Начальным действительно научным обоснованием теории атома, считалась работа английского математика Дж. Дальтона. Ученый познавал свойства газообразных веществ, а также рассматривал отношения объемов газов.
Спустя более трех тысяч лет – концепция науки начала больше полагаться на опыт и знания математики. Физики современности узнали, что атом является делимым, а также не обладает прочностью или неизменностью. Знания о строении атома сильно поменялись в 20 веке под действием новых теоретических мыслей и опытной базы.
Считается, что атом это мелкая частица, на которую можно разложить материю без образования электрических зарядов. Также атому присущи свойства химического элемента.
Основная часть атома – это замкнутое пространство. Вторая часть состоит из протонов и нейтронов, окруженных электронным облаком. Электроны способны притягиваться к положительным зарядам. В ядре сосредоточена большая часть массы атома. Протоны и нейтроны обладают длительным жизненным циклом, присутствующих во всех атомах при обычных условиях. Другие частицы атома могут быть созданы при добавлении большого числа энергии, но они недолговечны.
Крупная часть материи состоит из совокупности молекул, которые могут разделяться. Молекулы состоят из атомов, соединенных химическими связями, разорвать которые непросто. В состав атома входят электроны и ядра. Данные частицы электрически заряжены, а электрические силы отвечают за удержание атома на его позиции. Чтобы разделить такие частицы, необходимо иметь большое количество энергии.
Из-за происхождения квантовой механики трудно составить мысль, полностью приходящуюся при реализации отдельных характеристик атома, что призывает физиков применять заимствованные воображения для объяснения различных свойств. Данное явление приметно при изучении электронного строения атома в двух частях:
- Электроны в атоме действуют как частицы, крутящиеся вокруг ядра;
- Электроны ведут себя, как волновые линии, остановившиеся вокруг ядра
Среди ученых нашей страны большое действие в изучение и анализ теории атома внес М.В. Ломоносов. Он выделял две части материи:
- Элементы;
- Корпускулы
В 1897 году произошло открытие электрона, а Дж. Томсон создал современную модель строения атома, но его открытие со временем опровергли.
Критика модели Томсона сильно противоречила исследованиям Эрнеста Резерфорда. Данный ученый является первооткрывателем ядерной физики. Благодаря Резерфорду было доказано, что электроны двигаются вокруг ядра атома.
Крупный расклад в анализе атомного строения был проведен Н. Бором. Именно он предположил, что описание атома должно согласовываться с представлениями классической физики. В 1939 год был открыт атом Урана.
На основании рассмотренных данных, можно сделать заключения:
- Атом – сложная частица, которая обладает множеством разновидных свойств;
- Представления об атом выдвигаются зарубежными и отечественными учеными на протяжении долгих лет;
- Атомная концепция является неотъемлемой частью при изучении курса квантовой механики в любых образовательных и научных целях;
- Благодаря теории атома ученые смогли изучить основные виды химической связи, которые нашли свое применение во многих прикладных науках;
- Большинство законов ядерной физики стоят на фундаменте знаний об атоме
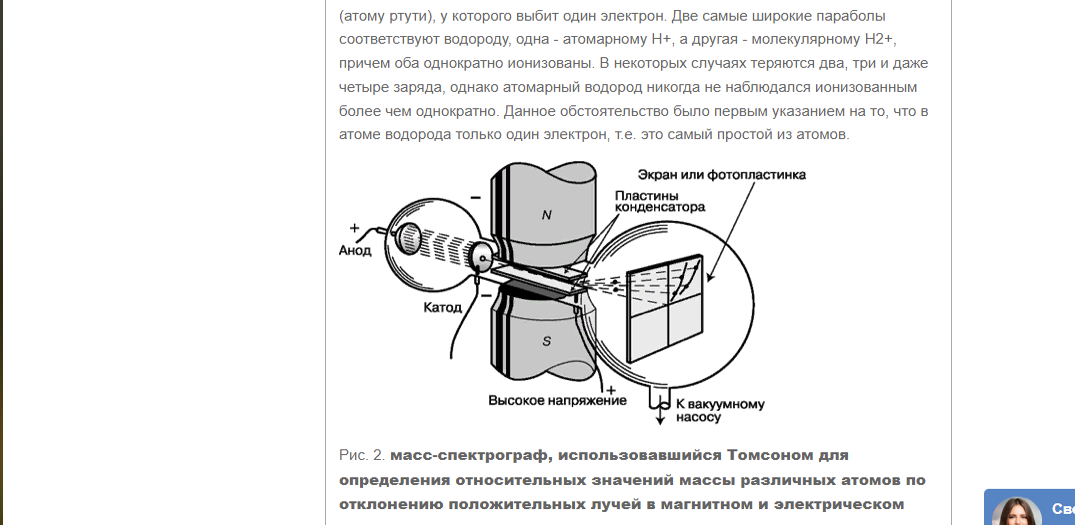
Рис.1- масс-спектрограф
Список литературы
- Кумар, М. Квант: Эйнштейн, Бор и великий спор о природе реальности / М., АСТ, CORPUS ¾ 2015, с. 591
- Юшкевич, А. П., История математики в средние века / М., Дрофа, 1961
- Давыдов, А.С. Квантовая механика: Учебное пособие / А.С. Давыдов. - СПб.: BHV, 2011. - 704 c.



