Базовые положения, принятые при этих исследованиях:
- Химические элементы имеют состояние А0 в физической системе с параметрами Е0=0 э.в., т.е. при Т=0, Р=0, H=0 (температура, давление, напряженность электромагнитного поля).
- Если в физической системе выполняется условие P>0; T>0; H>0 то энергетическое состояние этой системы отвечает значениюEi>E0, а химические элементы представлены атомными частицами (A+i).
- Образование вещества происходит в конкретной физической системе с определенными значениями P,T,H. Энергетическое состояние этой системы можно отождествить с определенными значениями Ei. Все химические элементы, находящиеся в этой системе, находятся в виде атомных частиц в энергетическом состоянии Ei (система гомогенезированна физически).
- Электронное строение атомных частиц определяется степенью их возбуждения. Дискретный характер перехода в возбужденное состояние, доказывает существование промежуточных стабильных форм атомных частиц.
Для примера рассмотрим атомную частицу кислорода в интервале 35,1>E>13.6 э.в.
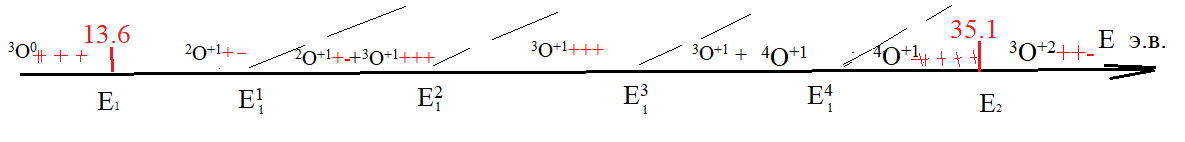
Рис. 1. Возможные промежуточные стабильные формы атомных частиц O+1
в интервале 35,1 э.в.> E>13,6 э.в.
В интервале E1-E11в возбуждении находятся 2 p-орбитали с находящимся на них одним электроном. Данную атомную частицу можно показать, как2O+1.
В интервале E21-E31в возбуждении находятся 3p-орбитали с тремя электронами. Данную атомную частицу можно показать, как3O+1.
В интервале E31-E2в возбужденном состоянии находятся sи3p орбитали с расположенными на них пятью электронами. Данную атомную частицу можно показать, как 4O+1.
В интервале Е11-Е12 существуют 2О+1 и 3О+1совместно, В интервале Е13-Е14 существуют 3О+1 и 4О+1 совместно.
- Химическая связь образуется «гибридными молекулярными орбиталями», являющимися общими для атомных частиц, участвующих в образовании вещества. Гибридные молекулярные орбитали образованы электронными орбиталями атомных частиц, находящимися в возбужденном состоянии.
- Устойчивое состояние вещества наступает при полном заполнении гибридных молекулярных орбиталей, находящимися на них «возбужденными электронами» - данная комбинация атомных частиц, с заполненными молекулярными орбиталями, становится диамагнитной для своего электромагнитного поля, которое его и сохраняет.
Характеристики химических веществ, использованные в работе, взяты из работы Неорганическая Химия, химия элементов. Академкнига, 2007 г. (4).
Опорная точка сопоставления реальной физической системы (Tо) и теоретической E получена при изучении серы (S) и ее оксидов. Известно, что при T Cона кристаллическая и представлена несколькими аллотропными формами: моноклинной, ромбической, аморфной. На основании этого было сделано следующее допущение: T
C это физическая граница перехода разных фаз атомных частиц серы. Т.е. в интервале 120
она существует в «холодной» формеS2. Значит ES1<ES2, было сделано предположение, что T
Предполагаемая динамика физико-химических состояний атомных частиц S, О, N, Cl, Р, С, Са показана на Рис. 2, составы и рассчитанные строения молекул некоторых веществ показаны в таблице № 1.
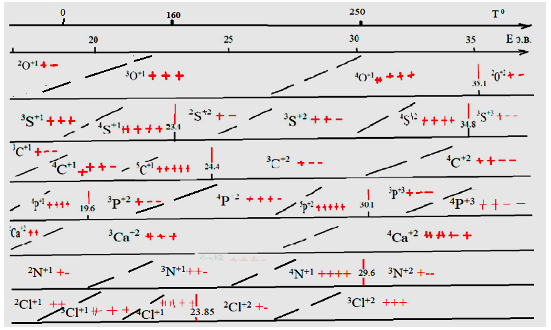
Рис. 2. Динамика предполагаемых состояний атомных частиц кислорода, серы, углерода, фосфора, кальция в определённых параметрах физического поля.
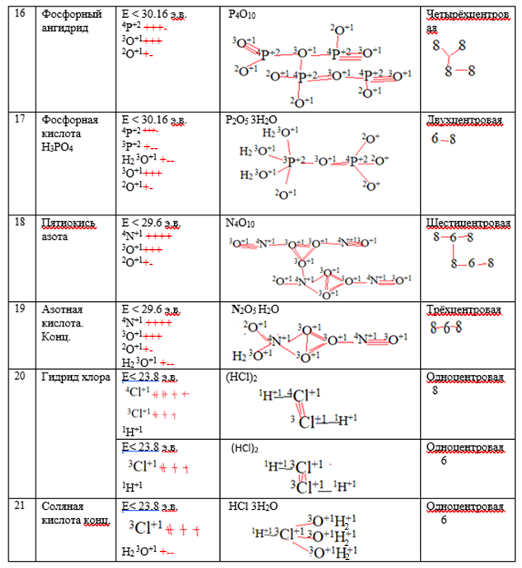
Рассчитанные составы и строение молекул некоторых веществ
Таблица 1.
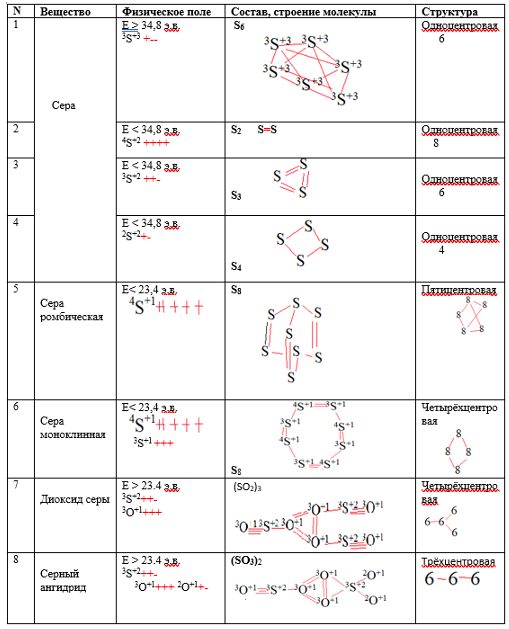

Признавая, что 23.4 э.в. это примерно 1600С рассмотрим образование молекул кислорода и воды, самые важные для жизнедеятельности биологической фауны и флоры. Параметры физической системы на поверхности планеты Земля – давление 1 атмосфера, температура средняя 150+/-20, кислород существует в виде 3О+1 и 2О+1(рис. 2). Первая форма является энергонасыщенной, по сравнению с второй формой, скорее всего эта форма кислорода используется лёгкими при дыхании из атмосферного воздуха. В его составе общее содержание кислорода в пределах 20%, но что интересно – только 2% используется лёгкими. Очень странная эффективность работы лёгких, всего 10%. Это хорошо объясняется в следующем допущении – в составе атмосферного воздуха 90% это форма 2О+1 и только 10% в форме 3О+1, он и используется лёгкими.
Рассмотрим молекулу углекислого газ
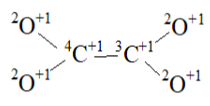
СО2 – устойчивая форма молекулы образуется из комбинации 4С+1, 3С+1 и четырёх атомных частиц 2О+1, образуя одноцентровуюмолекулус центром 4С+1, с расположенными на р-орбиталях остальных атомных частиц (3 электрона у 4С+1 и по одному у остальных, имеем 8 электронов на 4 орбиталях).Можно сделать вывод что в лёгких происходит поглощение энергии у 3О+1 и переход его в форму 2О+1 и он выводится в виде углекислого газа СО2.
Подтверждением о соотношении 3О+1 и 2О+1 в “нормализованных“ условиях являются аллотропные формы карбоната Са – арагонит и кальцит. Арагонит при нагревании (1) переходит в кальцит, то есть арагонит — это низкотемпературная форма существования карбоната кальция. Кальцит химически получен “из бикарбонатных растворов при температуре < 300С” (3). Кальцитом сложены раковины морских моллюсков тёплых морей. Рассчитанный состав молекулы имеет вид.
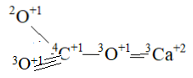
Молекула имеет 2 центра - 4C+1 и 3Ca+2, структура 8-6. Соотношение 3О+1 к 2О+1 2:1. Плотность минерала 2,6-2,7 г/cм3.
Арагонит — это минерал сталактитов, сталагмитов карстовых пещер. Рассчитанный состав молекулы имеет вид
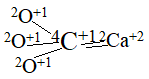
Это одноцентровая молекула с центром 4C+1, плотность 2.9 – 3.0 г/см3. Кислород в форме 3О+1 отсутствует, атомная частица кальция имеет форму 2Ca+2. Приведённые факты подтверждают, что при Т> 300C содержание кислорода в форме 3О+1 значимое, а при Т <300Cсодержание очень малое, в составе арагонита его нет. Правильность рассчитанных формул арагонита и кальцита подтверждает следующее – кристаллизация в структуре кальцита или арагонита определяется размером катиона превышает 1,1 Å, минерал кристаллизируется в структуре арагонита. Если же радиус катиона меньше, чем. 1 Å, то получаем Структуру кальцита. Ca[CO3](RCa2+=1,04 Å) занимает промежуточное положение.
(Лазаренко Е.К. с. 467). В кальците атомная частица3Ca+2 без р-орбиталей, они участвуют в образовании молекулярных орбиталей, в арагоните атомная частица 2Ca+2 с одной р-орбиталью, 2 р-орбитали участвуют в образовании молекулярных орбиталей. Атомная частица3Ca+2 имеет меньший размер чем 2Ca+2.
Кислород в форме 2О+1 может образовать молекулу состава О4 (2 молекулярные орбитали с 4 электронами, находящимися в возбуждённом состоянии). Кислород в форме 3О+1 образует молекулу состава О2 (3 молекулярные орбитали с 6 электронами, находящимися в возбуждённом состоянии). Возможна ещё одна форма 3О+1 + 3 2О+1 = ОО3, центром молекулы является 3О+1, 2О+1 располагаются вокруг него. Три молекулярные орбитали и 6 электронов, находящихся в возбуждённом состоянии.
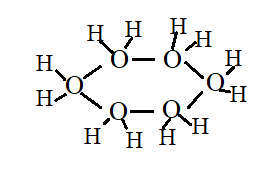
Рассмотрим строение молекулы воды.
Кислород в форме 3О+1 с тремя электронными орбиталями и на них по 3 электрона, 2 электрона купируются атомными частицами Н+1, в результате имеем Н23О+1 с 3 возбуждёнными орбиталями и одним электроном, находящимся в возбуждённом состоянии. Стабильная комбинация получается из 6 таких атомных частиц, а формула молекулы воды отвечает составу (Н2О)6.
Твёрдая фаза воды – лёд имеет сингонию-гексогональная (L66P), вид симметрии дигексогонально-пирамидальный (1. Бетехтин А.Г. с. 298). Вспомним форму снежинки, имеем полное совпадение.
Следующие точки сопоставления реальной физической системы (T0) и теоретической E, проверки методики расчета состава и строения молекулы вещества — это алмаз и его переход в графит, породообразующие минералы магматических горных пород. Полученные результаты по образованию молекул алмаза, графита, оливина, ортопироксена приведены (Рис.№ 3, таблица 2).
Таблица 2.
Рассчитанный состав и строение отдельных минералов
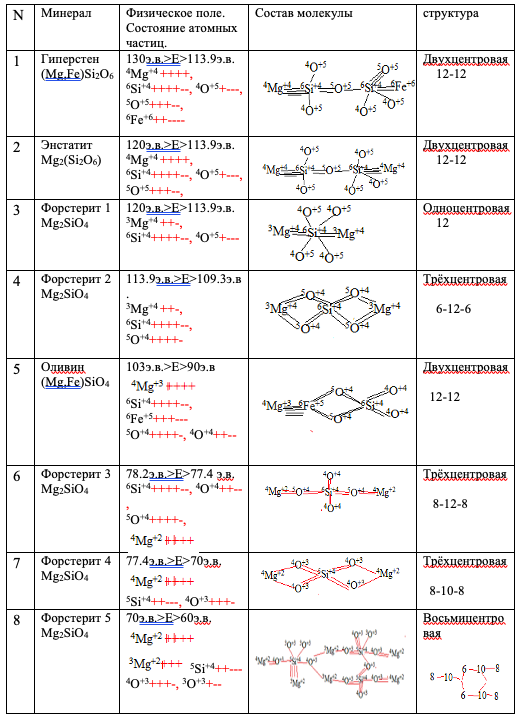
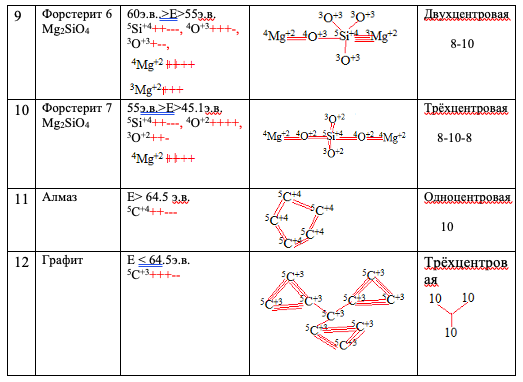
Известно (4) что алмаз при медленном остывании при T
Образование магматических горных пород происходит взаимосвязано с развитием активной геологической структуры, завершающейся созданием нового участка Земной Коры. Общий возраст Земной Коры в пределах 4 млрд. лет, её становление происходило циклично в виде активных геологических структур разного ранга. По закономерностям развития геологических структур и выделение их в Шкале Геологического времени, автором опубликована статья в журнале Вестник РУДН 2011 N 1. Эта работа сделана на основе собственного опыта, работая геологом, с привлечением опубликованного материала. По результатам этой работы определена цикличность в развитии активной геологической структуры. Выделены 4стадии – Ранняя, Орогенная, Позднеорогенная, Посторогенная, работа была сделана в 1986-1987 годах, поэтому названия даны по Советской геологической школе того времени. Эти стадии развития активной геологической структуры можно назвать их синонимами – Детство, Юность, Зрелость, Старость. Законы развития Материального Мира едины. Каждая стадия геологического развития характеризуется определённым составом магматических горных пород при общей направленности от преобладания ультраосновных, основных пород в Ранней, до преобладания кислых и ультракислых пород в Посторогенной. Общий тренд по температурам кристаллизации этих магм от более высокотемпературных к более низким, то есть гомодромный.
В составах породообразующих минералах магматических горных пород основными являются Si и O. Предполагаемая динамика атомных частиц Si, О, Mg, Fe и других приведена на рис. 3. Очень интересные материалы получены при расчетах составов оливинов. Оливин Mg2SiO4 — это минерал кристаллизующийся, как правило, самым первым из магматического расплава. Получилось, что оливины, кристаллизующиеся в интервале 130 E
45,1 э.в., характеризуются как минимум 8политипийнымиформами (Таблица №2. 3-10). Дополнительно, изучив образование ромбического пироксена, получено полное совпадение с реально зафиксированным фактом более ранней кристаллизацией ромбического пироксена (таблица 2 (п 1; 2) по отношению к оливину, а его ранняя фаза – гиперстен, а не энстатит. Это характерная черта массивов ультраосновного состава дунит-гарцбургитовой формации с промышленными месторождениями хромитов, характерных для Ранней стадии развития активной геологической структуры. Эталоном данного типа массивов является Кемпирсайский массив на Южном Урале. Политипийная форма оливина табл. 2, 8 сопоставима с так называемой структурой «спинифекс», являющейся характерной для оливинов из массивов ультраосновных пород, залегающих в гранито-гнейсовыхкуполах с промышленными месторождениями никелевых и медно-никелевых руд.

Рис. 3. Динамика атомных частиц в условиях сопоставимыми с магматическими очагами
По результатам расчётов основных породообразующих минералов магматических горных пород можно сделать следующие выводы:
Каждая Стадия геологического развития активной Геологической структуры характеризуется индивидуальным набором аллотропных, политипийных форм породообразующих минералов, так как они образуются из единой, для этой Стадии, физической системы. Определены вероятные границы физических систем для каждой стадии геологического развития активной геологической структуры (рис. 3, интервалы А-Б, Б-В, В-Г, Г-Д)
- В каждой последующей Стадии геологического развития атомные частицы, участвующие в образовании породообразующих минералов, имеют строение, соответствующее новой физической системе. Образующиеся минералы последовательно становятся более “рыхлыми”, так как в образовании молекулярных гибридных орбиталей принимают участие всё более внешние электронные орбитали атомных частиц. Происходит увеличение объёма новообразованных минералов магматических пород. Это и является механизмом расширения нашей планеты в геологическом времени. Данное положение распространяется и на осадочный чехол планеты, который сложен минералами, образовавшимися в физической системе более низкого уровня, чем магматические.
- По результатам исследований выделены интервалы физических полей для каждой Стадии геологического развития:
- Ранняя стадия – породообразующие минералы образуются из атомных частиц, находящихся в физическом поле в интервале 113,9 – 130 э.в. (рис. 3 интервал А-Б)
- Орогенная стадия - породообразующие минералы образуются из атомных частиц, находящихся в физическом поле в интервале 77.4 – 113.9 э.в. (рис. 3 интервал Б-В)
- Позднеорогенная стадия- породообразующие минералы образуются из атомных частиц, находящихся в физическом поле в интервале 54.9 – 77.4 э.в. (рис. 3 интервал В-Г)
- Посторогенная стадия - породообразующие минералы образуются из атомных частиц, находящихся в физическом поле в интервале45.1 – 54.9 э.в. (рис. 3 интервал Г-Д)
- Используя все результаты исследований по расчету состава и строению молекул веществ, которые были проведены (десятки веществ и минералов), построен график по соответствию абсолютной температуры То и энергетического состояния физического поля Е э.в. рис. 4.
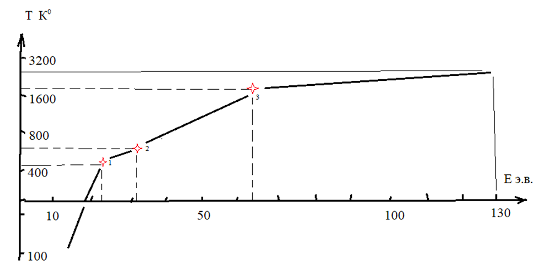
Рис. 4. Примерное соответствие абсолютной температуры физического поля и его потенциала ионизации. Точка 1 – переход S+1 в S+2 , точка 2 – переход Р+2 в Р+3 (белый фосфор – красный фосфор), точка 3 – переход алмаза в графит (С+4 - С+3 )
Вывод. Предположив, что вещество — это устойчивая комбинация атомных частиц, электронное строение которых создается физическим полем, предложены:
- Механизм изменения электронного строения атомных частиц в зависимости от состояния физического поля (рис. 1, 2, 3);
- Определены условия, при которых комбинация атомных частиц будет устойчива, образуется молекула вещества;
- Приведены на рисунках и таблицах полученные результаты (частично).
- Получены данные по сопоставлению, коррекции параметров физического поля в разных единицах измерения.
- Образование вещества происходит в физическом поле, по физическим законам.
- Вещество – промежуточная стабильная форма существования материи в определённом интервале физического поля.
Предлагаемая гипотеза образования веществ, позволяет:
- Отказаться от абстрактных терминов “анион, катион, степень окисления, валентность”, а работать с конкретными атомными частицами (их промежуточными стабильными формами), существующими в определённом интервале физического поля.
- Рассчитывать состав и строение молекул веществ. Энергетическое состояние атомных частиц в веществе позволяет определить физические параметры поля, в котором оно образовалось.
- Эти результаты могут стать основой для рассмотрения вопросов эволюции материи во времени, уровнях организации материи в разных системах – звёзды, планеты, межзвёздное пространство.
Список литературы
- Бетехтин А.Г. Курс минералогии,.2007
- Колесников В.Н. Закономерности в развитии геологических структур. Шкала геологического времени. Вестник РУДН. № 1. 2011 г. С. 5-14
- Лазаренко Е.К. Курс минералогии
- Неорганическая химия. Т.1-2. Академкнига. Москва. 2017



